
【题目】莽草酸可用于合成药物达菲,莽草酸的结构简式如图所示。下列关于莽草酸的说法正确的是( )
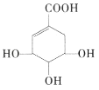
A.分子式为![]() B.分子中含有2种官能团
B.分子中含有2种官能团
C.可发生加成反应和取代反应D.1mol莽草酸与足量的Na反应,标况下生成33.6LH2
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
已知:C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
则煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH=____________________。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
(1)如图所示能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是____________。

(2)在一定温度下,向2.0 L固定容积的密闭容器中充入2 mol H2和1 mol CO,经过一段时间后,反应4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
时间/min | 0 | 20 | 40 | 80 | 100 |
n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
①0~20 min的平均反应速率v(CO)=__________________mol·L-1·min-1;
②达到平衡时,H2的转化率为__________________;
③在上述温度下,该反应的平衡常数K=______________________;
④能表明该反应达到平衡状态的是________(填序号);
A CO的转化率等于H2O的产率 B 混合气体的平均相对分子质量不变
C v(CO)与v(H2)的比值不变 D 混合气体的密度不变
⑤在上述温度下,向平衡后的2 L容器中再充入0.4 mol H2和0.4 mol CH3OCH3(g),则化学平衡________移动(填“向左”“向右”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,它可以发生反应的类型有( )
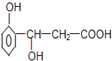
①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚
A. ①②③④B. ①②④⑤
C. ①②⑤⑥D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
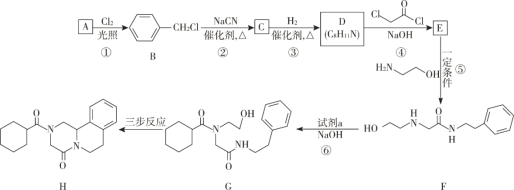
【题目】吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
已知:I R-Cl+NaCN![]() R-CN+NaCl
R-CN+NaCl
ii 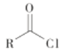 +R′-NH-R"+NaOH
+R′-NH-R"+NaOH![]()
 +NaCl+H2O(R、R′表示烃基,R"表示烃基或H)
+NaCl+H2O(R、R′表示烃基,R"表示烃基或H)
(1)A 属于芳香烃,其名称是________________________。
(2)步骤②的反应类型是_______________________________。
(3)B 的一种同分异构体,含苯环且核磁共振氢谱中出现三组峰,其结构简式为______________。
(4)③中 1mol C 理论上需要消耗__________________mol H2生成 D。
(5)④的化学方程式是 ________。
(6)F 中含氧官能团是 ![]() 和_______________________(填名称)。
和_______________________(填名称)。
(7)试剂 a 的结构简式是___________________。
(8)G→H 分为三步反应,J 中含有 3 个六元环,写出 I、J 的结构简式。
![]()
I:_____;J:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《环境科学》曾刊发我国科研部门采用零价铁活化过硫酸钠(Na2S2O7其中S为+6价)去除废水中的正五价砷的研究成果,其反应机理模型如图,(NA为阿伏加德罗常数的值)下列说法正确的是
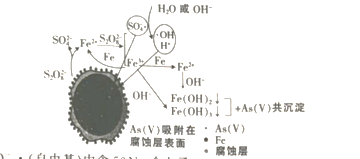
A.1 molSO4-· (自由基)中含50NA个电子
B.pH越大,越不利于去除废水中的正五价砷
C.1 mol过硫酸钠中含NA个过氧键
D.转化过程中,若共有1 mol S2O82-被还原,则参加反应的Fe为56 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为元素在生物体内的含量分布情况,下列表述错误的是
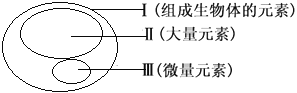
A. P、S、K、Ca、Zn属于大量元素
B. 在非生物界中都能找到,体现生物界与非生物界的统一性
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
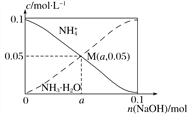
A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.为了探究一种固体化合物甲(仅含3种元素)的组成和性质,设计并完成如下实验:(气体体积已经换算成标准状况下的体积)
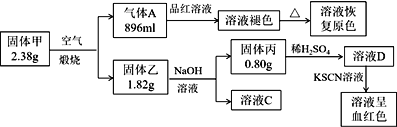
请回答:
(1)写出化合物甲的化学式________。
(2)写出形成溶液C的化学方程式:_____________。
(3)写出气体A通入溶液D中,发生反应的离子反应方程式__________。
Ⅱ.近年来化学家又研究开发出了用 H2和CH3COOH 为原料合成乙醇(反应Ⅰ),同时会发生副反应Ⅱ。
反应Ⅰ.CH3COOH(g)+2H2(g)![]() CH3CH2OH(g) +H2O(g) △H1
CH3CH2OH(g) +H2O(g) △H1
反应Ⅱ. CH3COOH(g)+H2(g)![]() CO(g)+CH4(g)+H2O(g) △H2>0
CO(g)+CH4(g)+H2O(g) △H2>0
已知:乙醇选择性是转化的乙酸中生成乙醇的百分比。请回答:
(1)反应Ⅰ一定条件下能自发进行,则△H1 ___0。(填“>”或“<”)
(2)某实验中控制 CH3COOH 和 H2 初始投料比为 1∶1.5,在相同压强下,经过相同反应时间测得如下实验数据:
温度(K) | 催化剂 | 乙酸的转化率(%) | 乙醇选择性(%) |
573 | 甲 | 40 | 50 |
573 | 乙 | 30 | 60 |
673 | 甲 | 55 | 35 |
673 | 乙 | 40 | 50 |
①有利于提高CH3COOH转化为CH3 CH2OH平衡转化率的措施有______。
A 使用催化剂甲 B 使用催化剂乙
C 降低反应温度 D 投料比不变,增加反应物的浓度
E 增大CH3COOH和H2的初始投料比
②673K甲催化剂作用下反应Ⅰ已达平衡状态,测得乙酸的转化率为50%,乙醇的选择性40%,若此时容器体积为 1.0L,CH3COOH 初始加入量为2.0mol,则反应Ⅰ的平衡常数 K= _____。
③表中实验数据表明,在相同温度下不同的催化剂对CH3COOH转化成CH3CH2OH的选择性有显著的影响,其原因是_________________。
(3)在图中分别画出I在催化剂甲和催化剂乙两种情况下“反应过程-能量”示意图。_____

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究小组用粗铜(含杂质Fe) 为原料制备CuCl2·2H2O晶体,再用CuCl2·2H2O晶体制备CuCl。
(1)制备CuCl2·2H2O晶体:
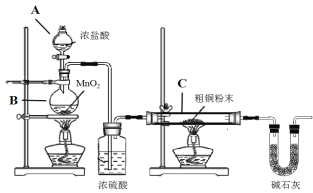
① B装置中发生反应的化学方程式是_________________
② 装置C中粗铜粉末(含杂质Fe)与气体充分反应时的生成物是______________
③ 反应完成后,将C中的固体用稀盐酸完全溶解,再调节pH值除杂,经一系列操作便可获得CuCl2·2H2O晶体。溶解C中生成物固体时,有时会加入少量双氧水,目的是__________
(2)制取CuCl,为了制取CuCl采用如图所示装置进行实验(夹持仪器略):
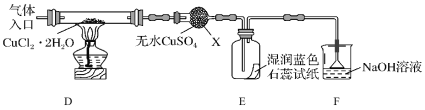
已知:![]()
④仪器X的名称是__________
⑤实验操作的先后顺序是a→__________________________→e(填操作的编号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
⑥装置F中NaOH溶液的作用是___________________。
⑦ 反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质。请分析产生CuCl2杂质的原因是__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com