
【题目】在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表。忽略溶液体积变化,下列叙述不正确的是( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
A. 2 min时H2O2的浓度c(H2O2)=0.314mol/L
B. 0~4 min的平均反应速率v(H2O2)=3.75×10-2mol/(L·min)
C. 6~10 min,过氧化氢的平均反应速率v(H2O2)=2.75×10-2mol/(L·min)
D. 反应到6 min时,H2O2分解了50%
【答案】C
【解析】
由△n(H2O2)=2n(O2),根据v=△c/△t计算。
A. 2 min时,△n(H2O2)=2n(O2)=2![]() 8.6
8.6![]() mol,△c(H2O2)=
mol,△c(H2O2)=![]() =0.086 mol/L,则H2O2的浓度c(H2O2)=0.40mol/L -0.086 mol/L =0.314mol/L,故A正确;
=0.086 mol/L,则H2O2的浓度c(H2O2)=0.40mol/L -0.086 mol/L =0.314mol/L,故A正确;
B. 0~4 min,△n(H2O2)=2n(O2)=2![]() 1.5
1.5![]() mol,△c(H2O2)=
mol,△c(H2O2)=![]() =0.15 mol/L,则平均反应速率v(H2O2)=
=0.15 mol/L,则平均反应速率v(H2O2)=![]() =3.75×10-2mol/(L·min),故B正确;
=3.75×10-2mol/(L·min),故B正确;
C. 6~10 min,△n(H2O2)=2n(O2)=2![]() 6.7
6.7![]() mol,△c(H2O2)=
mol,△c(H2O2)=![]() =0.067 mol/L,则过氧化氢的平均反应速率v(H2O2)=
=0.067 mol/L,则过氧化氢的平均反应速率v(H2O2)=![]() =1.68×10-2mol/(L·min),故C错误;
=1.68×10-2mol/(L·min),故C错误;
D. 反应到6 min时,△n(H2O2)=2n(O2)=2![]() 2
2![]() mol,△c(H2O2)=
mol,△c(H2O2)=![]() =0.2 mol/L,则H2O2分解了
=0.2 mol/L,则H2O2分解了![]() =50%,故D正确;
=50%,故D正确;
答案选C。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA
B. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加2NA个P-Cl键
C. 28 g N60单质(见图)中含有的N-N(σ)键个数为3NA
D. 235g核互![]() 发生裂变反应:
发生裂变反应:![]() +
+![]() +
+![]() +10
+10![]() ,净产生的中子(n)数为10NA
,净产生的中子(n)数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种关于酸的使用,其中正确的是
A. 为了抑制Fe2+的水解,用稀硝酸酸化 B. 检验溶液中是否含有SO![]() 时,先用盐酸酸化
时,先用盐酸酸化
C. 乙酸与乙醇的酯化反应中,浓硫酸起到了催化剂和脱水剂的作用 D. 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂能用于鉴别SO2和CO2气体的是( )
①石灰水 ②H2S溶液 ③KMnO4溶液 ④氯水 ⑤品红溶液
A.①②③④⑤B.③④
C.①②③⑤D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4在生产、生活、卫生医疗中常用作消毒剂,高锰酸钾造成的污渍可用还原性的草酸(H2C2O4 )去除,Fe(NO3)3也是重要氧化试剂,下面是对这两种氧化剂性质的探究。
(1)取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量的是________mol。
(2)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.395 g KMnO4样品溶解酸化后,用0.100 mol/L标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在________(填“酸式”或“碱式”)滴定管中。实验中,滴定至终点时消耗Na2S2O3溶液12.50 mL,则该样品中KMnO4的质量分数是________。(有关离子方程式为:8MnO4-+5S2O32-+14H+=8Mn2++10SO42-+7H2O)
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。溶液先变为浅绿色的离子方程式是_______________,又变为棕黄色的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如图所示,下列有关说法错误的是( )

A. 曲线 M 表示 pH与lg![]() 的变化关系
的变化关系
B. Ka2(H2Y)=10-4.3
C. d 点溶液中: c(H+)-c(OH -)=2c(Y2-)+ c(HY-)-c(K+)
D. 交点 e 的溶液中: c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入100 mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol·L-1 NaOH溶液,整个过程中pH的变化如图所示。下列有关叙述正确的是
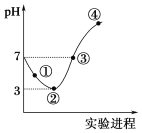
A. 曲线③④段有离子反应:HClO+OH-===ClO-+H2O
B. 可依据②处数据计算所溶解的n(Cl2)
C. ③处表示氯气与氢氧化钠溶液恰好反应完全
D. ①处c(H+)约为②处c(H+)的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常用的酸碱指示剂酚酞的结构简式如图所示,下列关于酚酞的说法不正确的是( )
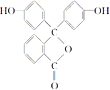
A. 酚酞属于芳香族化合物
B. 酚酞的分子式为C20H14O4
C. 分子中所有碳原子可能共平面
D. 酚酞具有官能团羟基能与钠发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所涉及的物质均为中学化学中的常见物质,其中D为黄绿色的气体,E为Fe单质,它们存在如下转化关系,反应中生成的水及次要产物均已略去.
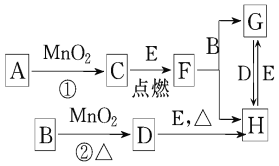
(1)写出有关物质的名称:B__________,F______________
(2)写出F与金属铝在高温下的反应化学方程式____________________________
(3)若反应①是在加热条件下进行的,则A是____________ (填化学式);
(4)指出MnO2在相关反应中的作用:反应②中是________剂.
(5)写出B与MnO2共热获得D的化学方程式: __________________________.
(6)实验室检验H中的阳离子的方法是______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com