
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:分析 (1)根据c=$\frac{1000ρw%}{M}$计算该浓盐酸中HCl的物质的量浓度;
(2)结合稀释定律:c1v1=c2V2计算即可.
解答 解:(1)由c=$\frac{1000ρw%}{M}$可知,该浓盐酸中HCl的物质的量浓度为$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L,答:该浓盐酸的物质的量浓度为11.9mol/L;
(2)由稀释定律:c1v1=c2V2可知,配制500mL0.4mol/L的稀盐酸,需用该浓盐酸为$\frac{0.5×0.4}{11.9}$L=0.0168L=16.8mL,答:需用量筒量取16.8ml上述浓盐酸.
点评 本题考查物质的量及物质的量浓度的相关计算,为高频考点,把握物质的量、浓度、体积之间的关系及配制溶液的计算等为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 过量CO2与澄清石灰水反应:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| B. | 向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7 Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中滴入过量的NaOH溶液Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| D. | 硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.24mol•L-1 | B. | 0.25mol•L-1 | C. | 0.34mol•L-1 | D. | 0.35mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥⑦ | B. | ①②④ | C. | ①②⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
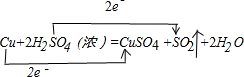 .该方程式的氧化剂为H2SO4;被氧化的元素为Cu.
.该方程式的氧化剂为H2SO4;被氧化的元素为Cu.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | Na2SO3固体、浓H2SO4 | SO2 | |
| Ⅳ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
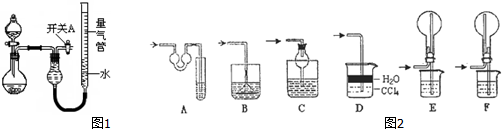
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:填空题
二水合重重铬酸钠(Na2Cr2O7.2H2O),[已知M(Na2Cr2O7.2H2O)=298g/mol]俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO.Cr2O3,还含有A1203、MgO、Si02等杂质)为主要原料生产,其主要工艺流程如图:
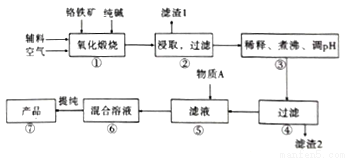
已知信息:
Ⅰ.“①”中涉及的主要反应是:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
Ⅱ.部分阳离子以氢氧化物形式完全沉淀时溶液的PH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液PH | 4.7 | 3.7 | 11.2 | 5.6 |
(1).杂质A12O3、SiO2与纯碱反应转变为可溶性盐,写出A12O3纯碱反应的化学方程式为:______________,滤渣1的主要成分为__________________。
(2).“③”中通过调节PH除去杂质,调节PH至___________。
(3).“⑤”中向滤液中加入物质A,得到Na2Cr2O3和Na2SO4的混合溶液,物质A为__________,简述原因:______________________________。(用离子方程式及文字加以说明)
(4).如图是Na2Cr2O3.2H2O和Na2SO4的溶解度曲线。提纯的实验操作:将Na2Cr2O3和Na2SO4的混合溶液______________________,得到Na2SO4固体和较纯净的Na2Cr2O3溶液。
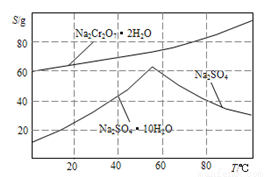
(5).实验室测定所得产品中红矾钠的纯度,称取产品3.2g,配成250mol溶液,取出25.00mL于锥形瓶中,加入10mL2mol/LH2SO4和足量碘化钾,放于暗处5min,写出离子方程式:________________。然后加水100mL,加入3mL淀粉指示剂,用0.1000mol/LNa2S2O3标准溶液滴定I2+2S2O32-=2I-+S4O62-若达到滴定终点时,共用去Na2S2O3标准溶液60mL,所得产品的纯度是_________(结果保留小数点后1位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com