
【题目】水的电离平衡曲线如图所示,下列说法正确的是( )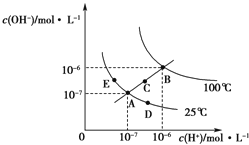
A.图中五点KW间的关系:B=C=A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性
【答案】B
【解析】A.ADE都处于250C时,Kw相等,B点c(H+)和c(OH﹣)都大于E点的c(H+)和c(OH﹣),并且C点的c(H+)和c(OH﹣)大于A点c(H+)和c(OH﹣),c(H+)和c(OH﹣)越大,Kw越大,故B>C>A=D=E,故A错误;
B.加酸,c(H+)变大,但c(OH﹣)变小,但温度不变,Kw不变,故B正确;
C.若从A点到C点,c(H+)变大,c(OH﹣)变大,Kw增大,温度应升高,故C错误;
D.若处在B点时,Kw=1×10﹣12 , pH=2的硫酸中c(H+)=10﹣2mol/L,pH=10的KOH中c(OH﹣)=10﹣2molL﹣1 , 等体积混合,恰好中和,溶液显中性,故D错误;
故选B.


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. Cl2通入水中:Cl+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
C. NaHCO3溶液跟足量的Ca(OH)2反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
D. H2SO4溶液中加入足量的Ba(OH)2溶液:SO42-+H++Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,将充满NO2的试管倒扣到盛水的水槽中,一段时间后,试管内气体的体积是试管体积的________________,假设试管内溶质不扩散,则试管内溶液中溶质的物质的量浓度为___________________。
(2)某铁的“氧化物”样品,用5mol/L的盐酸100mL恰好完全溶解,所得溶液还能吸收标准状况下1.12L氯气,使其中Fe2+恰好全部转化为Fe3+,发生反应的离子方程式为_________,该样品中Fe和O的个数比为_______________。
(3)向盛有10mL1mol/LNH4Al(SO4)2溶液的烧杯中滴加1mol/LNaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:(已知NH4++OH-=NH3·H2O)
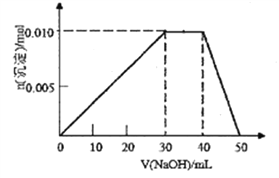
①写出滴加NaOH溶液40~50mL时反应的离子方程式:__________________。
②若10mL1mol/LNH4Al(SO4)2溶液中改加20mL1.15mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 用砂纸打磨过的铝箔在空气中加热,会熔化并剧烈燃烧
B. 向盛水的烧杯中投入一大块钠,这样现象更明显
C. 铁在纯氧中点燃,会剧烈燃烧,火星四射,生成氧化二铁
D. 铝制容器不可以用来长期存放酸性,碱性或咸的食物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《汉书》记载“高奴(县)有洧水可燃”;《梦溪笔谈》描述“洧水”:“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行于世”.上述有关“洧水”和“烟”的主要成分分别是( )
A.石油和炭黑
B.石油和焦炭
C.油脂和木炭
D.油脂和石墨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡. I、已知H2A在水中存在以下平衡:H2AH++HA﹣ , HA﹣H++A2﹣ .
(1)NaHA溶液的pH(填大于、小于或等于) Na2A溶液的pH.
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是 . a.c(H+)c(OH﹣)=1×10﹣14 b.c(Na+)+c(K+)=c(HA﹣)+2c(A2﹣)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0. ①降低温度时,Ksp(填“增大”、“减小”或“不变”).
②滴加少量浓盐酸,c(Ca2+)(填“增大”、“减小”或“不变”).
(4)II、含有Cr2O72﹣的废水毒性较大,某工厂废水中含5.00×10﹣3 molL﹣1的Cr2O72﹣ . 为使废水能达标排放,作如下处理: Cr2O72﹣ ![]() Cr3+、Fe3+
Cr3+、Fe3+ ![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①该废水中加入绿矾(FeSO47H2O)和H+ , 发生反应的离子方程式为: .
②欲使10L该废水中的Cr2O72﹣完全转化为Cr3+ , 理论上需要加入g FeSO47H2O.
③若处理后的废水中残留的c(Fe3+)=2×10﹣13molL﹣1 , 则残留的Cr3+的浓度为 . (已知:Ksp[Fe(OH)3]=4.0×10﹣38 Ksp[Cr(OH)3]=6.0×10﹣31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.下列有关说法正确的是( )
A.反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B.乙装置中铁电极为阴极,电极反应式为Fe﹣2e ﹣=Fe2+
C.通入氧气的一极为正极,发生的电极反应为O2﹣4e ﹣+2H2O═4OH﹣
D.反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com