
【题目】以铬铁矿[Fe(CrO2)2]为原料可制备K2Cr2O7和金属铬。实验流程如下:
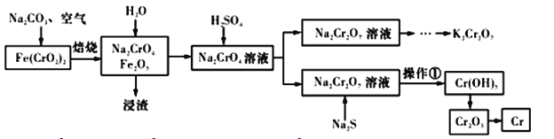
已知:2CrO42-+2H+=Cr2O72-+H2O。pH<3.0,CrO42-含量极小。
(1)写出铬铁矿焙烧转化为Na2CrO4的化学反应方程式:_____________________________________;焙烧时不能使用陶瓷容器的原因是________________________________________。
(2)加入稀硫酸后所得Na2Cr2O7溶液的pH应小于3.0,可用_________________测定溶液pH。
(3)操作①包括过滤和洗涤。实验室洗涤沉淀的操作是________________________________。
(4)Na2S的作用是①__________________________和②___________________________。
(5)Fe3+在pH为3.7时可完全转化为Fe(OH)3。在上述流程中所得Na2Cr2O7溶液中含有少量Fe3+。请结合下图有关物质的溶解度曲线,设计由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案(实验中须选用的试剂:硫酸溶液、NaOH溶液、KCl固体、蒸馏水)____________________。

【答案】4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2 陶瓷在高温下会与Na2CO3反应 pH计 沿玻璃棒加水至浸设沉淀,待水自然滤出后重复2~3次 调节溶液的酸碱度 将重铬酸钠还原为氢氧化铬 ①向Na2Cr2O7溶液中加入适量NaOH溶液调节pH大于3.7,过滤;②向①中滤液加入硫酸溶液至pH小于3.0,再加入适量KCl固体,蒸发浓缩,冷却结晶,过滤,洗涤,干燥
2Fe2O3+8Na2CrO4+8CO2 陶瓷在高温下会与Na2CO3反应 pH计 沿玻璃棒加水至浸设沉淀,待水自然滤出后重复2~3次 调节溶液的酸碱度 将重铬酸钠还原为氢氧化铬 ①向Na2Cr2O7溶液中加入适量NaOH溶液调节pH大于3.7,过滤;②向①中滤液加入硫酸溶液至pH小于3.0,再加入适量KCl固体,蒸发浓缩,冷却结晶,过滤,洗涤,干燥
【解析】
根据流程图可知,煅烧过程中,铬铁矿转化生成得到Na2CrO4、Fe2O3和CO2;溶解过滤得到含有杂质的Na2CrO4浸出液,调节溶液pH,过滤除去不溶性的物质,得到Na2CrO4溶液;向溶液中加入稀硫酸使CrO42-转化为Cr2O72--,得到Na2Cr2O7溶液;向Na2Cr2O7溶液中加入Na2S,Na2S调节溶液的酸碱度的同时将重铬酸钠还原为氢氧化铬;过滤、洗涤得到氢氧化铬沉淀,氢氧化铬受热分解得到氧化铬,氧化铬还原得到铬单质;向Na2Cr2O7溶液中加入KCl固体,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到K2Cr2O7。
(1)根据流程图可知,高温煅烧过程中,铬铁矿与纯碱、空气中氧气反应,转化生成Na2CrO4、Fe2O3和CO2,反应的化学方程式为4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4
2Fe2O3+8Na2CrO4
+8CO2;因陶瓷中含有二氧化硅,二氧化硅在高温下会与Na2CO3反应生成硅酸钠和二氧化碳。(2)要检测酸化操作中溶液的pH是否等于3.0,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计。而且该溶液是有色的强氧化剂,故不适宜用pH试纸测定其pH值。(3)实验室洗涤沉淀在过滤器中完成,洗涤沉淀的操作是沿玻璃棒向过滤器中加蒸馏水至浸没沉淀,待水自然滤出后,重复操作2~3次。(4)向Na2Cr2O7溶液中加入Na2S,由于其有还原性、且其水解可以使溶液显碱性,故Na2S的作用是调节溶液的酸碱度、将重铬酸钠还原为氢氧化铬。(5)由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案是先调节溶液pH,在pH为3.7时将Fe3+完全转化为Fe(OH)3沉淀,过滤,向滤液中加入硫酸溶液至pH小于3.0,以减少铬酸根离子;依据题给溶解度曲线可知,重铬酸钾的溶解度随温度变化较大,故向除杂后的溶液中加入KCl固体,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,通过复分解反应将Na2Cr2O7转化为溶解度更小的K2Cr2O7晶体。


科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.乙烯的化学性质比乙烷活泼
B.乙烯燃烧时火焰明亮,同时产生黑烟
C.乙烯的结构简式为CH2=CH2
D.乙烯双键中的一个键可以断裂,容易发生加成反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的描述不正确的是( )
A. MgF2的电子式:![]()
B. 中子数为15的硅原子:![]()
C. 次氯酸的结构式:H—Cl—O
D. NH3·H2O的电离方程式:NH3·H2O![]() NH4++OH—
NH4++OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题。该小组设计的简单实验装置如图所示,该实验的主要操作步骤如下:
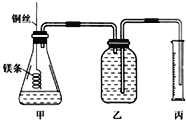
配制100ml1.0mol·L-1的盐酸溶液,用______(填仪器名称并注明规格)量取10.0ml1.0mol/L的盐酸溶液加入锥形瓶中;用托盘天平称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为_________;往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
(1)请将上述步骤补充完整。
(2)用文字表述实验步骤④中检查装置气密性的方法:__________________________。
(3)实验步骤⑤中应选用_________(填序号)的量筒。
A.100ml B.200ml C.500ml
(4)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积Vm=_____________,若未除去镁条表面的氧化膜,则测量结果___________________(填“偏大”、“偏小”或“无影响”)。
(5)若在配制盐酸过程中出现下列情况,将使所配制的溶液的浓度偏高的是___________(填各选项的序号)。
a.配制溶液所用的容量瓶洗净后没有烘干
b.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
c.最后确定HCl溶液体积(定容)时,俯视观察液面与容量瓶刻度线
d.定容摇匀后静置,发现液面低于刻度线,再加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏伽德罗常数的值.下列说法不正确的是 ( )
A. 1molCH4中含4NA个s﹣pσ键
B. 1molSiO2晶体中平均含有4NA个σ键
C. 12g石墨中平均含1.5NA个σ键
D. 12g金刚石中平均含有2NA个σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用麻醉药苄佐卡因E和食品防腐剂J的合成路线如下:
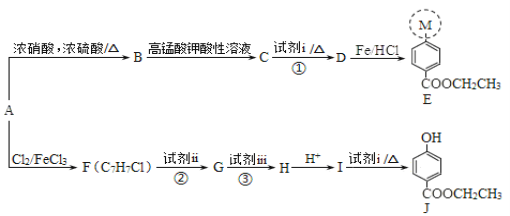
已知:I.M代表E分子结构中的一部分
II.![]()
请回答下列问题:
(1)A属于芳香烃,分子式为C7H8 ,其名称是_______,A到B的反应类型是______________________。
(2)E中所含含氧官能团的名称是_______,M的结构简式是__________。
(3)C能与NaHCO3溶液反应,则反应①的化学方程式是_____________。
(4)反应②、③中试剂ii和试剂iii依次是_______。(填序号)
a.高锰酸钾酸性溶液、氢氧化钠溶液
b.氢氧化钠溶液、高锰酸钾酸性溶液
(5)H的结构简式是_______。
(6)J有多种同分异构体,其中符合下列条件的同分异构体有______ 种,写出其中任一种同分异构体的结构简式:____。
a.为苯的二元取代物
b.遇到FeCl3溶液显紫色,能发生水解反应且能发生银镜反应
(7)以A为起始原料,选用必要的无机试剂合成涂改液的主要成分亚甲基环己烷(![]() ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭 头上注明试剂和反应条件):_____________
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭 头上注明试剂和反应条件):_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低合金高强度钢是支撑"鸟巢"的铁骨钢筋,除含有铁元素外,还含有Mn(锰),Ti(钛),(铬),(铌)等合金元素,下列有关说法正确的是( )
A. Fe位于元素周期表的第四周期,第VIIIB族
B. 46TiO、 48TiO、50TiO互为同位素
C. Mn 2O7是酸性氧化物
D. ![]() 原子核内有个51个中子,核外有 41个电子
原子核内有个51个中子,核外有 41个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com