
分析 N2和H2按1:4的体积比进行混合,取0.5mol 该混合气体在一定条件下于容积固定的 2L密闭容器中发生反应,二者的物质的量分别为0.5mol×$\frac{1}{5}$=0.1mol、0.5mol×$\frac{4}{5}$=0.4mol,则
N2(g)+3H2(g)?2NH3(g)
开始 0.1 0.4 0
转化 x 3x 2x
平衡 0.1-x 0.4-3x 2x
到平衡时容器内的压强为反应前压强的0.88倍,则$\frac{0.1-x+0.4-3x+2x}{0.5}$=0.88,解得x=0.03,
(1)结合v=$\frac{△c}{△t}$计算;
(2)由上述分析可知,达到平衡后,混合气体中氨的物质的量为2x;
(3)转化率=$\frac{转化的量}{开始的量}$×100%;
(4)合成氨为放热、且体积减小的反应,结合温度、压强对平衡、速率的影响分析.
解答 解:N2和H2按1:4的体积比进行混合,取0.5mol 该混合气体在一定条件下于容积固定的 2L密闭容器中发生反应,二者的物质的量分别为0.5mol×$\frac{1}{5}$=0.1mol、0.5mol×$\frac{4}{5}$=0.4mol,则
N2(g)+3H2(g)?2NH3(g)
开始 0.1 0.4 0
转化 x 3x 2x
平衡 0.1-x 0.4-3x 2x
到平衡时容器内的压强为反应前压强的0.88倍,则$\frac{0.1-x+0.4-3x+2x}{0.5}$=0.88,解得x=0.03,
(1)2min 时,v(H2)=$\frac{\frac{3×0.03mol}{2L}}{2min}$=0.015mol/(L•min),故答案为:0.015;
(2)达到平衡后,混合气体中氨的物质的量为2×0.03mol=0.06 mol,故答案为:0.06;
(3)平衡时H2的转化率为$\frac{3×0.03}{0.4}$×100%=22.5%,故答案为:22.5%;
(4)工业上合成氨适宜条件是合适的温度、压强、使用催化剂,
A.温度500℃,反应速率及转化率较大,故A选;
B.压强100MPa,对设备的要求较高,故B不选;
C.铁触媒,作催化剂,加快反应速率,故C选;
D.压强20MPa~50MPa,可加快反应速率,利用合成氨,对设备要求不高,故D选;
故答案为:A、C、D.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、速率及转化率计算为解答的关键,侧重分析与计算能力的考查,注意合成氨条件的选择与工业生产的关系,题目难度中等.


科目:高中化学 来源: 题型:选择题
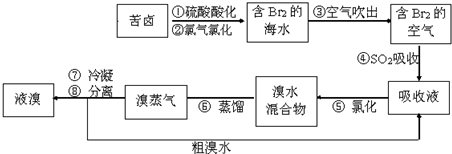
| A. | 步骤④⑤是为了富集溴 | |
| B. | 步骤③说明溴具有挥发性 | |
| C. | 步骤④的离子方程式为Br2+SO2+H2O═2H++2Br-+SO32- | |
| D. | 步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 活性炭/mol | NO/mol | A/mol | B/mol | p/MPa | |
| 200℃ | 2.00 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.050 | 0.0250 | 0.0250 | p |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
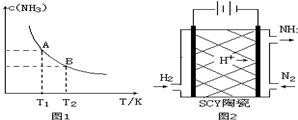
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

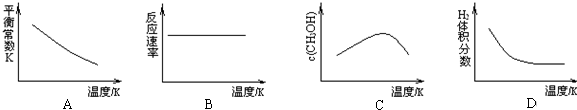
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
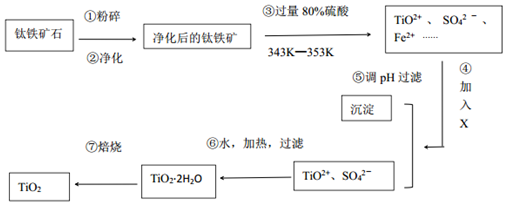
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4只做还原剂 | |
| B. | 10mol CuSO4可氧化P的物质的量为2mol | |
| C. | Cu3P既是氧化产物,又是还原产物 | |
| D. | 生成1mol Cu3P时,被氧化的P的物质的量为2.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 松花蛋 | B. | 纯净水 | C. | 可乐 | D. | 馒头 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com