
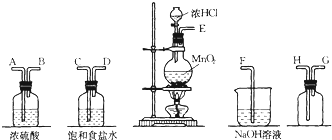
分析 (1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;反应中消耗1mol二氧化锰,有2mol氯化氢被氧化,生成1mol氯气,据此解答;
(3)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,依据氯气、氯化氢的溶解性选择合适的除杂剂,依据浓硫酸具有吸水性,选择浓硫酸做干燥剂,干燥氯气;
(4)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,碘遇到淀粉变蓝;
(5)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
解答 解:(1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气,装置连接顺序是 E C D A B H G F,
故答案为:C D A B H G;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;反应中消耗1mol二氧化锰,有2mol氯化氢被氧化,生成1mol氯气,所以当0.5mol MnO2参与反应时,被氧化的HCl的质量为1mol,质量为36.5g;生成氯气的物质的量为0.5mol,标况下气体的体积为0.5mol×22.4L/mol=11.2L;
故答案为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O; 36.5g; 11.2L;
(3)盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,选择饱和食盐水除去氯气中的氯化氢;
浓硫酸具有吸水性,选择浓硫酸做干燥剂,干燥氯气;
故答案为:①除去Cl2中的HCl; ②干燥氯气;
(4)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,化学方程式:;Cl2+2 KI=I2+2 KCl,碘遇到淀粉变蓝;
故答案为:试纸变蓝;Cl2+2 KI=I2+2 KCl;
(5)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2 NaOH=NaCl+NaClO+H2O;
故答案为:Cl2+2 NaOH=NaCl+NaClO+H2O.
点评 本题考查了实验室制备干燥纯净的氯气的实验步骤和试剂选择,明确制备原理和氯气的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{27}^{60}$Co原子核内含有60个质子 | |
| B. | Co-59和Co-60质子数相同,两者可互称为同位素 | |
| C. | ${\;}_{27}^{59}$Co原子核内含有22个中子 | |
| D. | ${\;}_{27}^{60}$Co原子的最外层电子数为27 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.请回答下列问题:
为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CH3COOK的质量为98 g•mol-1 | |
| B. | CH3COOK的摩尔质量等于它的相对分子质量 | |
| C. | 一个CH3COOK微粒的质量约为98 g/NA | |
| D. | 含有6.02×1023个碳原子的CH3COOK的物质的量为1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 限制生产含磷洗衣剂-防止湖海出现“赤潮” | |
| B. | 严禁排放未经处理的有毒工业废水-防止水土流失 | |
| C. | 不允许焚烧农作物秸秆-防止污染空气 | |
| D. | 限制生产不符合尾气排放标准的汽车-防止氮氧化物污染空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 难溶物 | 溶度积Ksp |
| Mg(OH)2 | 1.8×10-11 |
| Al(OH)3 | 1.0×10-33 |
| Fe(OH)3 | 8.0×10-38 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com