
【题目】常温下0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数随pH变化的关系如图所示.下列表述正确的是( )
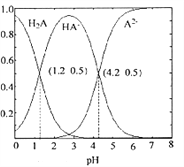
A. 在含H2A、HA-、A2-的溶液中,通入少量HCl,HA-的物质的量分数一定变大
B. 将等物质的量的NaHA、Na2A溶于水中,所得溶液中存在:c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH-)
C. 在 0.1mol/L NaHA 溶液中,各离子浓度大小关系为:
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
D. 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2
【答案】C
【解析】A. 据图可知,随溶液pH增大,HA-的物质的量分数先增大后减小,在含H2A、HA-、A2-的溶液中,通入少量HCl,溶液pH减小,则HA-的物质的量分数可能增大也可能减小,故A错误;B. 将等物质的量的NaHA、Na2A溶于水中,根据电荷守恒可知:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),故B错误;C. 据图可知,当HA-的物质的量分数最大时,溶液呈酸性,说明HA-的电离程度大于水解程度,在 0.1mol/L NaHA溶液中,因HA-发生电离,则c(Na+)>c(HA-),因水也能电离出H+,则c(H+)>c(A2-),溶液呈酸性,OH-的浓度最小,所以各离子浓度的大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故C正确;D. 将等物质的量的NaHA、Na2A溶于水中,若HA-和A2-浓度相等,则Ka2=![]() =10-4.2,c(H+)=10-4.2,pH=4.2,因HA-的电离程度大于水解程度,则溶液中c(A2-)>c(HA-),所得溶液pH不等于4.2,故D错误;答案选C。
=10-4.2,c(H+)=10-4.2,pH=4.2,因HA-的电离程度大于水解程度,则溶液中c(A2-)>c(HA-),所得溶液pH不等于4.2,故D错误;答案选C。


科目:高中化学 来源: 题型:
【题目】铜和锌在工业中有重要作用。回答下列问题:
(1)已知氢氧化铜能溶于氨水形成[Cu(NH3)4]2+,则1mol[Cu(NH3)4]2+中含有______个σ键。
(2)CuO和Cu2O都能溶于盐酸,且Cu2O易发生歧化反应,写出Cu2O与盐酸反应的离子方程式________。
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”),原因是_______________________。
(4)ZnF2具有较高的熔点(872℃),而ZnCl2、ZnBr2、ZnI2熔点都比较低,原因是________________。
(5)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为_____________,C原子的杂化形式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现“绿色奥运”,下列建议不合理的是( )
A. 推广使用无磷洗涤剂 B. 推广垃圾分类存放、回收和处理
C. 提倡使用手帕,减少餐巾纸的使用 D. 提倡使用一次性塑料餐具和塑料袋
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在500℃时隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有FeO、Fe2O3和Fe3O4,气体产物可能有NH3、N2、H2O、SO3和SO2)。下列说法正确的是( )

A. 装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰
B. 装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3
C. 取①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则残留物一定为Fe2O3
D. 装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的NH3和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列溶液一段时间后再加入一定量的某种物质(方括号内物质),能够使溶液恢复到原来的成分和浓度的是( )
A. AgNO3 [AgNO3] B. NaOH [H2O]
C. KCl [KCl] D. CuSO4 [Cu(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用下列试剂中的一种就能将FeCl3、CuCl2、MgCl2和NaCl四种溶液区别开的是 ( )
A. H2SO4溶液 B. BaCl2溶液 C. NaOH溶液 D. AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 在化学反应过程中,发生物质变化的同时不一定发生能量变化
B. 煤、石油、天然气均为化石能源,是非再生能源
C. 生成物的总焓大于反应物的总焓时,反应吸热,ΔH<0
D. ΔH的大小与热化学方程式的化学计量数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某硫酸试剂瓶的标签上的部分文字。据此,下列说法正确的是

A. 该试剂中加入适量蒸馏水可以获得较稀的硫酸溶液
B. 该试剂瓶的标签上应印有如图所示的警示标记

C. 该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2mol/L
D. 在50mL量筒中配制0.1000mol/L硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该工业废水中回收硫酸亚铁和金属铜。请根据流程图,回答下列问题。

(1)写出对应物质的化学式:①为________________________,②为_____________________________,A中含有的物质____________________。
(2)操作②的名称为__________________。
(3)母液中含有的离子主要有(填离子符号):__________________。
(4)操作③包括_______________________________和过滤,再经洗涤、干燥操作可以得到纯净的FeSO47H2O晶体,。
(5)在上述流程中,涉及到的离子方程式有______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com