
 “诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图,下列关于“诺龙”的说法中不正确的是( )
“诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图,下列关于“诺龙”的说法中不正确的是( )| A. | 既能发生加成反应,也能发生酯化反应 | |
| B. | 既能发生氧化反应,也能发生还原反应 | |
| C. | 分子式是C18H26O2 | |
| D. | 能在NaOH醇溶液中发生消去反应 |
分析 根据有机物的结构简式确定元素的种类和原子个数,可确定有机物分子式,该有机物中含C=O、C=C、-OH,结合烯烃和醇的性质来解答.
解答 解:A.含C=C、C=O,能发生加成反应,含-OH,能发生酯化反应,故A正确;
B.含C=C、-OH能发生氧化反应,含C=O能发生还原反应,故B正确;
C.由结构可知,1个分子中含18个C、26个H、2个O原子,则分子式为C18H26O2,故C正确;
D.与-OH相连的C的邻位C上含H,则能发生消去反应,反应条件为浓硫酸并加热,故D错误.
故选D.
点评 本题考查有机物的结构与性质,侧重醇、烯烃的性质的考查,注意把握官能团与性质的关系即可解答,明确有机反应中加氢去氧为还原反应,题目难度不大.


科目:高中化学 来源: 题型:解答题
 ,则
,则 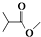 分子式:C5H8O2.
分子式:C5H8O2. .
. .
. 有多种同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是:
有多种同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是: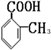 、
、 ;
; ,
,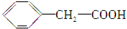 (任意两种)(任写其中二种).
(任意两种)(任写其中二种).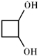 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,4.48 L N2和O2的混合气体中所含原子数为0.4NA | |
| B. | 常温下,1.0 L 1.0 mol•L-1NaAlO2溶液中含有的氧原子数为2NA | |
| C. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| D. | 0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
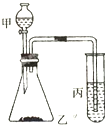 比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实
比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
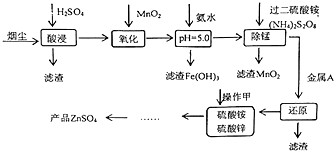 高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.如图是用高炉烟尘制取硫酸锌的工业流程.
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.如图是用高炉烟尘制取硫酸锌的工业流程.| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com