
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A | |||||||||||||||||
B | C | D | E | F | T | ||||||||||||
G | H | I | J | K | L | ||||||||||||
M | N | O | |||||||||||||||
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X反应的化学方程式_______。
(2)D的气态氢化物的VSEPR模型的名称为_______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数比= _______________。
(4)要证明太阳上是否含有R 元素,可采用的方法是__________________________。
(5)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是_________(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______________________。
(6)往O2+溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,写出沉淀溶解的离子方程式_____。
(7)若F 、K两种元素形成的化合物中中心原子的价电子全部参与成键,则该化合物的空间构型的名称为___。
(8)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是__(填m、n、x或y)。

(9)1183 K以下纯N晶体的基本结构单元如 所示,1183 K以上转变为
所示,1183 K以上转变为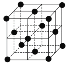 所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
【答案】8Al+3Fe3O4![]() 4Al2O3+9Fe 四面体 1:1 对太阳光进行光谱分析 非极性
4Al2O3+9Fe 四面体 1:1 对太阳光进行光谱分析 非极性 ![]() Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+ + 2OH- + 4H2O 正八面体 m
Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+ + 2OH- + 4H2O 正八面体 m ![]() 或68% 12 面心立方最密堆积
或68% 12 面心立方最密堆积
【解析】
A为H,R为He,B为Li,C为C,D为N,E为O,F为F,T为Ne,G为Na,H为Mg,I为Al,J为Si,K为S,L为Cl,M为Cr,N为Fe,O为Cu。
(1)Fe的单质和水蒸气反应能生成固体Fe3O4,则Al与Fe3O4反应生成Fe和Al2O3,其化学方程式8Al+3Fe3O4 ![]() 4Al2O3+9Fe;故答案为:8Al+3Fe3O4
4Al2O3+9Fe;故答案为:8Al+3Fe3O4 ![]() 4Al2O3+9Fe。
4Al2O3+9Fe。
(2)D的气态氢化物NH3的价层电子对数为![]() ,VSEPR模型的名称为四面体形;故答案为:四面体形。
,VSEPR模型的名称为四面体形;故答案为:四面体形。
(3)由A、C、D形成的ACD分子HCN,其结构为H—C≡N,σ键和π键个数比为1:1;故答案为:1:1。
(4)要证明太阳上是否含有He元素,可采用的方法是对太阳光进行光谱分析;故答案为:对太阳光进行光谱分析。
(5)①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,CCl4、CS2是非极性分子,根据相似相溶原理得出ME2L2是非极性分子;故答案为:非极性。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成Cu—Al—浓硝酸原电池,则组成负极材料是铜,其外围电子轨道表示式为![]() ;故答案为:
;故答案为:![]() 。
。
(6)往Cu2+溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,发生的是氢氧化铜和氨水反应生成四氨合铜子、氢氧根和水,其沉淀溶解的离子方程式Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+ + 2OH- + 4H2O;故答案为:Cu(OH)2+ 4NH3·H2O = [Cu(NH3)4]2+ + 2OH- + 4H2O。
(7)若F、K两种元素形成的化合物中中心原子的价电子全部参与成键则形成SF6,则该化合物的空间构型的名称为正八面体;故答案为:正八面体。
(8)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,沸点最高的是H2O,因此m为H2O,n为HF,x为NH3,y为CH4,则E的氢化物为H2O,其所在的折线是m;故答案为:m。
(9)在1183 K以下的晶体中,则该晶体为体心立方,设原子半径为r,根据体对角线为4r,则晶胞参数为![]() ,则空间利用率为
,则空间利用率为 ;在1183 K以上的晶体中,晶体堆积方式为面心立方最密堆积,与N原子等距离且最近的N原子数为12;故答案为:
;在1183 K以上的晶体中,晶体堆积方式为面心立方最密堆积,与N原子等距离且最近的N原子数为12;故答案为:![]() 或68%;12;面心立方最密堆积。
或68%;12;面心立方最密堆积。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成(CH3)4NOH,其工作原理如下图所示(a、b为石墨电板,c、d、e为离子交换膜),下列说法正确的是( )

A. M为正极 B. c、e均为阳离子交换膜
C. b极电极反应式:2H2O-4e-=O2↑+4H+ D. 制备1mol(CH3)4NOH,a、b两极共产生0.5mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 A、B、C、D 的原子序数依次递增,它们的核电荷数之和 32,原子最外层电子数之和为 10,A与 C同主族,B与 D同主族,A、C原子最外层电子数之和等于 B 原子的次外层电子数,则下列叙述中正确的是
A.一定条件下,B 单质能置换出 D 单质,C 单质能置换出 A 单质
B.四种元素的原子半径:r(A)<r(B)<r(C)<r(D)
C.B、D 的最高价氧化物中,B、D 与氧原子均为双键
D.D 元素处于元素周期表中第 3 周期第Ⅳ族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D四种元素原子半径由小到大的顺序为_______________________。
(2)A、F形成某种化合物的晶胞结构如下图(其中A显-3价),则其化学式为___(每个球均表示1个原子)。

(3)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为________,其晶体类型为_______,晶体中1个A原子周围最近距离且等距离的C原子数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钠是一种基础化工原料。
(1)已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(l) ΔH=-186 kJ·mol-1,3ClO-(aq)=ClO3— (aq)+2Cl-(aq) ΔH=-113 kJ·mol-1,则:3Cl2(g)+6OH-(aq)=ClO3—(aq)+5Cl-(aq)+3H2O(l)ΔH=____kJ·mol-1,该反应中生成1molClO3—,转移电子数为____。
(2)工业上采用无隔膜电解饱和食盐水可制备氯酸钠。该工艺过程中,生成氯酸钠的相关反应为:Cl2+H2O![]() H++Cl-+HClO,HClO
H++Cl-+HClO,HClO![]() H++ClO-,2HClO+ClO-=ClO
H++ClO-,2HClO+ClO-=ClO![]() +2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。
+2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。

①电解过程中,为按化学计量数比反应,需控制电解液的pH约为___(填序号)。
A.5 B.6.8 C.7.2D.7.5
②若电解液碱度过大,阳极会有较多的O2放出,电极反应方程式为____。已知:Cr2O72—+H2O![]() 2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
③若电解液pH<5时,溶液中HClO浓度会随pH减小迅速降低,其原因是____(用离子方程式表示)。
(3)电解时须对电解槽进行冷却处理以防止电解液温度过高的原因是____。
(4)氯酸钠与硫酸酸化的双氧水溶液反应常用于制备饮用水消毒剂ClO2(g),该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了以下实验验证Ag与浓硝酸反应的过程中可能产生NO.其实验流程图如下:

(1)测定硝酸的物质的量反应结束后,从如图装置B中所得100mL溶液中取出25.00mL溶液,用0.1molL-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示.在B容器中生成硝酸的物质的量为_________mol,则Ag与浓硝酸反应过程中生成的NO2在标准状况下的体积为_________mL。
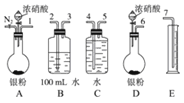
(2)测定NO的体积
①从如图3所示的装置中,你认为应选用_________装置进行Ag与浓硝酸反应实验,选用的理由是_________。
②选用如图3所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是_________填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_________(填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中_________(填“有”或“没有”)NO产生,作此判断的依据是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季下雪后,城市道路常使用融雪剂,其主要成分的 化学式为 XY2,X、Y 均为周期表前 20 号元素,其阳离子和阴离子电子层结构相同,且 1 mol XY2 含有 54 mol 电子。
(1)该融雪剂的化学式是___________,该物质中化学键类型是___________。
(2)元素 D、E 原子的最外层电子数是其电子层数的 2 倍,D 与 Y 相邻,则 D 的 离子结构示意图是___________;D 与 E 能形成一种结构类似于 CO2 的三原子 分子,且每个原子均达到了 8e-稳定结构,该分子的电子式为___________, 化学键类型为___________ (填“离子键”或“共价键”)。
(3)W 是与 D 同主族的短周期元素,Z 是第三周期金属性最强的元素,Z 的单质 在 W 的常见单质中反应时有两种产物:不加热时生成___________,其化学键类型为___________;加热时生成___________,其化学键类型为___________,电子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.64 g铜丝加热下在足量硫黄蒸气里完全反应后,失去的电子数为NA
B.0.2 mol NO和0.1 mol O2充分反应后,混合物的分子数为0.2NA
C.1 mol SO2溶于足量水,溶液中H2SO3、HSO3-与SO32-粒子的物质的量之和为NA
D.l00g质量分数为46%的乙醇水溶液中氧原子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com