
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
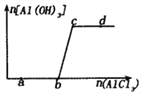
A. a点对应的溶液中: Na+、K+、SO42-、HCO3-
B. b点对应的溶液中:Na+、ClO-、SO42-、Cl-
C. c点对应的溶液中: Ag+、H+、Ca2+、NO3-
D. d 点对应的溶液中: K+、NH4+、OH-、Cl-
科目:高中化学 来源: 题型:
【题目】粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④HCl,加入的先后顺序可以是( )
A.①②③④B.②③①④C.②①③④D.③②④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
二 | C | N | ① | |||||
三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是(填写元素符号);①的核外电子排布式;③和⑥两元素形成化合物的电子式为 .
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是(填化学式).
(3)比较④、⑤两种元素的简单离子半径:>(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为 .
(4)列举一个事实来证明元素①比元素⑤的非金属性强 .
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量可以用来衡量一个国家石油化工发展水平.,B、C、D、E、F均为常见的有机物,在一定条件下,它们有如图所示的转化关系. 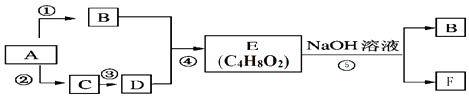
(1)a.则A的电子式为: b.能与金属钠反应放出氢气的物质有(填字母)
c.请书写反应④的方程式:
(2)某烃M相对分子质量为140,其中碳的质量分数为0.857.M分子中有两个碳原子不与氢原子直接相连.A在一定条件下氧化只生成G,G能使石蕊试液变红.已知 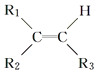
![]()
 +R3COOH
+R3COOH
试写出:化合物A和G的结构简式,A:G: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是进行科学探究、探求新知识的重要途径.某学习小组的同学设计如图装置探究铜片与浓硫酸的反应(加热、夹持装置略去). 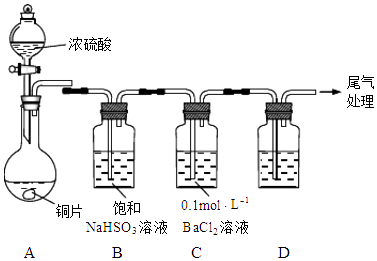
(1)探究I SO2的性质: A中铜片与浓硫酸的反应方程式为: .
(2)实验进行一段时间后,发现C中产生白色沉淀,经检验该沉淀为BaSO4 . 同学甲分析:A中温度过高,产生副产物SO3 , SO3进入C中与BaCl2反应生成BaSO4 . 你认为甲的分析合理吗?请说明理由. .
(3)若用装置D检验SO2的漂白性,则D中溶液是;处理尾气可用 . (填试剂名称)
(4)探究II 关于浓硫酸: 为测定浓硫酸的浓度,同学乙设计如下方案:
取适量该浓硫酸,稀释10倍后取出20mL置于锥形瓶中,滴入2滴酚酞作指示剂,用标准NaOH溶液进行滴定.如果装标准液的滴定管未用标准液润洗,会导致测定结果;如果锥形瓶用待测液润洗,会导致测定结果 . (填“偏高”、“偏低”或“不受影响”)
(5)为测定A中参加反应的硫酸的物质的量,同学丙设计如下方案: 待A中铜片完全溶解,冷却后将溶液稀释至500mL,再加入过量铁粉,使之充分反应,生成的气体在标况下的体积为16.8L;过滤得到残留固体,经洗涤、干燥、称量,比原铁粉质量减轻了35.6g.则A中参加反应的硫酸为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A. 钠和冷水反应:Na+2H2O==Na++2OH—+H2↑
B. 金属铝溶于氢氧化钠溶液:Al+2OH—==AlO2—+H2↑
C. 向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3·H2O =Al(OH)3↓+ 3NH4+
D. 铁与盐酸反应:2Fe+6H![]() =2Fe
=2Fe![]() +3H
+3H![]()
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com