
【题目】下列有关实验操作不能达到相应目的的是( )
|
|
|
|
A.干燥Cl2 | B.分离汽油与食盐溶液 | C.实验室制取少量蒸馏水 | D.比较Na2CO3与NaHCO3的稳定性 |
A. A B. B C. C D. D
【答案】D
【解析】
试题A、Cl2不能与浓硫酸反应,浓硫酸有吸水性,因此可以干燥Cl2,A正确;B、汽油与食盐溶液是互不相溶的两层液体物质,可以用分液的方法分离,B正确;C、水的沸点是100℃,把自来水加热,当水沸腾时,变为蒸汽,通过冷凝管,水蒸气被冷凝变为液态,用锥形瓶收集起来,就得到了蒸馏水,因此该装置可以用于实验室制取少量蒸馏水,C正确;D、由于碳酸氢钠受热易分解,因此比较Na2CO3与NaHCO3的稳定性时由于玻璃的导热性差,应该把Na2CO3放在外管,把NaHCO3放在内管,若观察到右边烧杯的石灰水显变浑浊,就证明稳定性:Na2CO3>NaHCO3,D错误,答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氯、钠、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态氯原子的价电子排布图是________________________;基态铜原子核外电子占有的空间运动状态有____________种
(2)碳、氮、氧三种元素中第一电离能最大的是____________ (填元素符号)CO32-中碳原子的杂化轨道类型为____________。
(3)相同条件下,水的沸点高于液氨,原因是________________________。
(4)铜与CNˉ可形成络合离子[Cu(CNˉ)4]2-,写出一种与CNˉ互为等电子体的分子的化学式____________;1 mol[ Cu(CNˉ)4]2-中含有____________molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为_________。
(5)氯化钠的晶胞如图所示。晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中。一个氯离子周围离氯离子最近的氯离子数目为__________个。已知:半径r(Clˉ)=apm,r(Na+)=bpm。摩尔质量M(NaCI)=cg·mol-1则氯化钠晶体的密度为_________g·cm-3

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷(C3H8)熔融盐燃料电池和锌蓄电池均为用途广泛的直流电源,放电时二者的总反应分别为C3H8+5O2=3CO2+4H2O,2Zn+O2=2ZnO。用丙烷(C3H8)燃料电池为锌蓄电池充电的装置如图所示,下列说法不正确的是

A. 物质M为CO2
B. 燃料电池消耗1mo1 O2时,理论上有4 mol OH-透过b膜向P电极移动
C. a膜、b膜均适宜选择阴离子交换膜
D. 该装置中,锌蓄电池的负极反应式为Zn+2OH--2e-=ZnO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用硫酸银与硫黄培烧制备氧化铝,再电解氧化铝,发生反应如下:反应Ⅰ:2A12(SO4)3+3S![]() 2Al2O3+9SO2↑
2Al2O3+9SO2↑
反应Ⅱ:2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
下列说法正确的是
A. 反应Ⅰ中S 单质是氧化剂
B. 反应Ⅱ中铝元素被氧化
C. 当生成5.4gAl时,反应Ⅰ和Ⅱ共转移1.2mole-
D. 反应Ⅰ中氧化产物与还原产物物质的量之比为2:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、SO2是大气污染物但又有着重要用途。
I.已知:N2 (g) + O2(g) = 2NO (g) ΔH1= 180.5kJ·mol1
C(s) + O2(g) = CO2(g) ΔH2 = 393.5kJ·mol1
2C(s) + O2(g) =2CO(g) ΔH3 =221.0kJ·mol1
(1)某反应的平衡常数表达式为K=![]() , 此反应的热化学方程式为:_________
, 此反应的热化学方程式为:_________
(2)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是_______(填序号)。
a.容器中的压强不变 b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持34.2不变 d.该反应平衡常数保持不变
e.NO和CO的体积比保持不变
II.(3)SO2可用于制Na2S2O3。为探究某浓度的Na2S2O3的化学性质,某同学设计如下实验流程:

用离子方程式表示Na2S2O3溶液具有碱性的原因___________。Na2S2O3与氯水反应的离子方程式是__________。
(4)含SO2的烟气可用Na2SO3溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为_________________________(任写一个)。离子交换膜______(填标号)为阴离子交换膜。

(5)2SO3(g)![]() 2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp= _______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡,再向容器中加入等物质的量SO2和SO3,平衡将___________(填“向正反应方向”或“向逆反应方向” “不”) 移动。
2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp= _______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡,再向容器中加入等物质的量SO2和SO3,平衡将___________(填“向正反应方向”或“向逆反应方向” “不”) 移动。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废旧锂离子二次电池(主要成分为LiCoO2,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
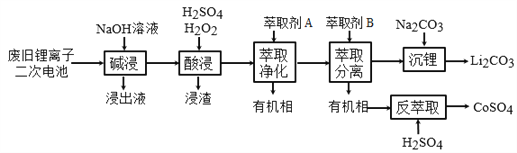
回答下列问题:
(1)“碱浸”的目的是_______。
(2)“酸浸”过程中LiCoO2发生反应的离子方程式为:___________________________
浸渣中含有的主要成分是________________。
(3)“萃取净化”除去的杂质离子有Ni2+外,还有_______。
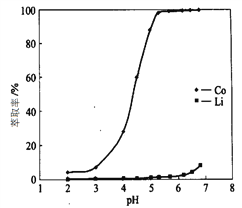
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示, pH一般选择5左右,理由是________。
(5)“沉锂”中Li2CO3溶解度随温度变化曲线如下图所示:
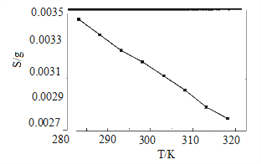
①根据平衡原理分析Li2CO3在水中溶解度随温度变化的原因_____________________。
②为获得高纯Li2CO3,提纯操作依次为趁热过滤、________、烘干。
③若“沉锂”中c(Li+)=1.0 mol·L1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为________。(已知Li2CO3的Ksp为9.0×10-4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2为还原产物),其电解的化学方程式为:3H2O+3O2![]() O3+3H2O2。下列有关说法正确的是
O3+3H2O2。下列有关说法正确的是
A. 电解池的阳极生成双氧水,阴极生成臭氧
B. 电解池中H+移向阴极
C. 产生臭氧的电极反应式为3H2O+6e-=O3+6H+
D. 产生双氧水的电极反应式为2H2O-2e- =H2O2+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是( )
A.棕红色的NO2加压后颜色先变深后变浅
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.黄绿色的氯水光照后颜色变浅
D.合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结晶玫瑰和高分子树脂M的合成路线如图所示:
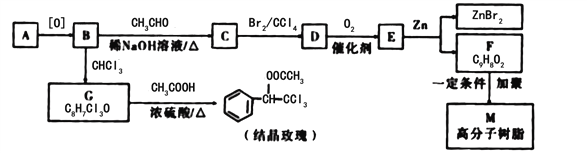
已知:①A是苯的同系物,在相同条件下,其蒸气相对于氢气的密度为46
②![]()
③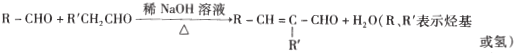
④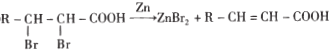
(1)C中含氧官能团的名称为______,E的结构简式为_____。
(2)写出由G生成结晶玫瑰的化学方程式________________________________。
(3)在上述流程中“C→D”在M的合成过程中的作用是___________________________
(4)己知G在一定条件下水解生成![]() ,写出H满足下列条件的同分异构体的结构简式______________________________
,写出H满足下列条件的同分异构体的结构简式______________________________
a与氯化铁溶液发生显色反应
b苯环上的一氯取代物只有一种
c与足量的氢氧化钠溶液反应,![]() 可消耗
可消耗![]() NaOH
NaOH
(5)E的同分异构体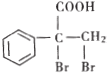 是一种重要的药物中间体,其合成路线与E相似,请以
是一种重要的药物中间体,其合成路线与E相似,请以![]() 为原料设计它的合成路线(其他所需原料自选)_______________.
为原料设计它的合成路线(其他所需原料自选)_______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com