
| A. | Fe3+、Mg2+、I-、SO42- | B. | NH4+、Al3+、NO3-、Cl- | ||
| C. | H+、Na+、Ca2+、ClO- | D. | Ba2+、K+、OH-、CO32- |
分析 A.铁离子能够将碘离子氧化成碘单质;
B.四种离子之间不发生反应,能够共存;
C.氢离子与次氯酸根离子结合生成弱电解质次氯酸;
D.钡离子与碳酸根离子结合生成难溶物碳酸钡.
解答 解:A.Fe3+、I-之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.NH4+、Al3+、NO3-、Cl-之间不反应,在溶液中能够大量共存,故B正确;
C.H+、ClO-之间反应生成次氯酸,在溶液中不能大量共存,故C错误;
D.Ba2+、CO32-之间反应生成碳酸钡沉淀,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.


科目:高中化学 来源: 题型:选择题
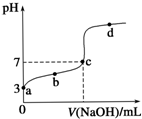 已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中c(CH3COO-)略小于10-3 mol•L-1 | |
| B. | b点表示的溶液中c(CH3COO-)>c(Na+) | |
| C. | c点表示CH3COOH和NaOH恰好完全中和 | |
| D. | b、d点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ 均等于K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由①知,氢气的燃烧热为241.8 kJ | |
| B. | 由①、②知,2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-443.4kJ/mol | |
| C. |  反应②中的能量变化可用如图表示 | |
| D. | 若反应②中改用固态硫,则放热大于20.1 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | ||
| Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下测定其pH等于7 | |
| B. | 一个标准大气压下测定其沸点为100℃ | |
| C. | 电解时产生H2、O2的体积比为2:1 | |
| D. | 室温时为无色的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 酸性强弱:H2SiO3<H2CO3<H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)下列数据是对应物质的熔点(℃)
(1)下列数据是对应物质的熔点(℃)| NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
 )所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.
)所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.| 化学键 | Si-O | Si-Si | O=O |
| 键能/KJ•mol-1 | 460 | 176 | 498 |
 )之间脱去两个水分子产物,其结构式为
)之间脱去两个水分子产物,其结构式为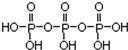 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平均相对分子质量 | B. | 混合气体的密度 | ||
| C. | 烧瓶内气体压强 | D. | 气体的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com