
| 元素 | T | X | Y | Z |
| 信息 | 原子最外层电子数比内层电子数多4 | 最高正价为+5,单质性质很稳定 | L层电子数比其他电子层电子数之和多5 | 单质、最高价氧化物(R)及对应的水化物均可与Y的最高价氧化物对应的水化物(M)反应 |
分析 短周期元素中,T原子最外层电子数比内层电子数多4,原子只能有2个电子层,最外层电子数为6,故T为O元素;X最高正价为+5,处于VA族,单质性质很稳定,则X为N元素;Y元素原子的L层电子数比其他电子层电子数之和多5,则原子有3个电子层,最外层电子数为8-2-5=1,故Y为Na元素;Y的最高价氧化物对应的水化物M为NaOH,Z的单质、最高价氧化物(R)及对应的水化物均可与NaOH反应,则Z为Al或Si,(2)中Z的单质及R在光伏电池产业、现代通讯产业中占据极为重要的位置,则Z为Si、R为SiO2,若Z能形成稳定的单核离子,则Z为Al,据此解答.
解答 解:短周期元素中,T原子最外层电子数比内层电子数多4,原子只能有2个电子层,最外层电子数为6,故T为O元素;X最高正价为+5,处于VA族,单质性质很稳定,则X为N元素;Y元素原子的L层电子数比其他电子层电子数之和多5,则原子有3个电子层,最外层电子数为8-2-5=1,故Y为Na元素;Y的最高价氧化物对应的水化物M为NaOH,Z的单质、最高价氧化物(R)及对应的水化物均可与NaOH反应,则Z为Al或Si等,(2)中Z的单质及R在光伏电池产业、现代通讯产业中占据极为重要的位置,则Z为Si、R为SiO2,若Z能形成稳定的单核离子,则Z为Al.
(1)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径Na>Si>N>O,即原子半径Y>Z>X>T,M为NaOH,含有离子键、共价键,
故答案为:Y>Z>X>T;离子键、共价键;
(2)Z的单质及R在光伏电池产业、现代通讯产业中占据极为重要的位置,则Z为Si、R为SiO2,二氧化硅与氢氧化钠反应生成硅酸钠与水,反应离子方程式为:SiO2+2OH-=SiO32-+H2O;
若Z能形成稳定的单核离子,则Z为Al,NaOH的碱性比Al(OH)3强,可以说明Al的金属性比Na的金属性弱,
故答案为:SiO2+2OH-=SiO32-+H2O;NaOH的碱性比Al(OH)3强;
(3)元素O与氢元素可形成原子个数比为1:1的化合物Q为H2O2,元素N与氢元素可形成原子个数比为1:2的化合物W为N2H4,Q与W按物质的量比为2:1的比例恰好反应生成X的单质和T的另一种氢化物,即二者反应生成氮气与水,该反应的化学方程式为:2H2O2+N2H4=N2↑+4H2O,
故答案为:2H2O2+N2H4=N2↑+4H2O.
点评 本题考查位置结构性质关系综合应用,推断元素是解题关键,需要学生具备扎实的基础,难度中等.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小的比较:r(X)>r(Y)>r(Z) | |
| B. | 元素Y、Z的简单离子的电子层结构不同 | |
| C. | 元素X的简单气态氢化物的热稳定性比元素Y的强 | |
| D. | 只含W、X、Y三种元素的化合物中,有离子化合物,也有共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴入硫酸溶液:Ba2++SO42-═BaSO4↓ | |
| B. | 向Na2CO3溶液中通入过量CO2气体:CO32-+CO2+H2O═2HCO3- | |
| C. | BaCO3溶于醋酸溶液:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| D. | 向溶液中加入100 mL水后,溶液的pH:③>④>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
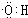 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.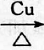 2CH3CHO+2H2O.
2CH3CHO+2H2O.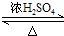 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.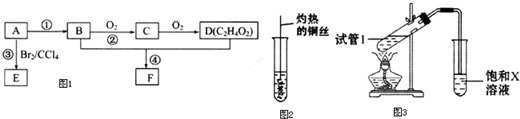
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “冰,水为之,而寒于水”说明相同质量的液态水和冰,液态水的能量高 | |
| B. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒直径不相同 | |
| C. | 液态氟化氢中存在氢键,所以其分子比氯化氢稳定 | |
| D. | 用福尔马林灭掉活埃博拉病毒是利用了蛋白质变性原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=14的溶液中:K+、Ca2+、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | 常温下,$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-10的溶液中:Na+、NH4+、SO42-、NO3- | |
| C. | c(ClO-)=1.0mol•L-1的溶液中:Na+、SO32-、S2-、SO42- | |
| D. | 0.1 mol•L-1的NaAlO2溶液中:NH4+、Fe3+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8 | B. | C2H6O | C. | C3H6O | D. | C2H4O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com