
【题目】如图是短元素周期表的一部分,①~⑨是元素周期表中的部分元素。
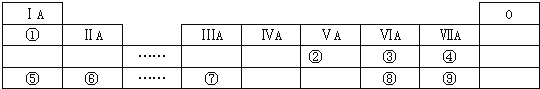
请回答下列问题:
(1)元素③④⑧的气态氢化物中最稳定的是__________(填化学式);
(2)元素⑤和⑦的最高价氧化物对应的水化物发生反应的离子方程式是_______________;
(3)元素⑥和⑨形成的化合物的电子式是________________;
(4)③、⑤、⑥形成的简单离子半径由大到小的顺序为_______________(写离子符号);
(5)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂;已知液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,写出A与B反应的化学方程式:___________________________;
(6)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:
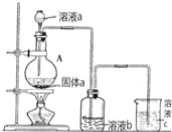
①浓溶液a和溶液b分别为_________、_______(写化学式);
②浓溶液a与黑色固体a反应的离子方程式为_____________________。
【答案】HF Al(OH)3+OH﹣=AlO![]() +2H2O
+2H2O ![]() O2﹣>Na+>Mg2+ N2H4+2H2O2=N2+4H2O 浓HCl Na2S(或H2S) MnO2+4H++2Cl﹣
O2﹣>Na+>Mg2+ N2H4+2H2O2=N2+4H2O 浓HCl Na2S(或H2S) MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
【解析】
由元素在周期表中的位置可知,①为H元素、②为N元素、③为O元素、④为F元素、⑤为Na元素、⑥为Mg元素、⑦为Al元素、⑧为S元素、⑨为Cl元素。结合物质的性质和元素周期律分析解答。
(1)元素的非金属性越强,氢化物越稳定,根据元素周期律,元素③④⑧中非金属性最强的是F元素,所以最稳定的氢化物是HF,故答案为:HF;
(2)Na的最高价氧化物对应的水化物是NaOH,Al的最高价氧化物对应的水化物是Al(OH)3,Al(OH)3与NaOH反应生成NaAlO2与水,反应的离子方程式为Al(OH)3+OH-=![]() +2H2O,故答案为:Al(OH)3+OH-=
+2H2O,故答案为:Al(OH)3+OH-=![]() +2H2O;
+2H2O;
(3)活泼非金属与活泼金属易形成离子化合物,故Cl与Mg形成离子化合物氯化镁,氯化镁的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4) O、Na、Mg的简单离子具有相同的电子层结构,Al核电荷数最大,离子半径最小,O的核电荷数最小,离子半径最大,所以简单离子的半径由大到小的顺序为:O2->Na+>Mg2+,故答案为:O2->Na+>Mg2+;
(5) 由表中两种元素形成的氢化物A和B都含有18个电子, A是一种6原子分子,可做火箭发动机的燃料,所以A是N2H4,B是一种常见强氧化剂,则B是H2O2,液态A与液态B充分反应生成一种液态10电子分子为水,和一种气态单质为氮气,二者反应的化学方程式为N2H4+2H2O2=N2+4H2O,故答案为:N2H4+2H2O2=N2+4H2O;
(6)①元素的非金属性越强,其单质的氧化性越强,要证明Cl元素非金属性大于S元素,可以利用氯气氧化硫的化合物生成硫单质即可,实验室常用浓盐酸和二氧化锰加热制取氯气,所以浓溶液a是浓HCl、溶液b是Na2S(或H2S)溶液,故答案为:浓HCl、Na2S(或H2S)溶液;
②浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
①![]()
![]() 和
和![]() 的混合气体中含有的原子个数为
的混合气体中含有的原子个数为![]()
②常温下,4g ![]() 含有
含有![]() 个
个![]() 共价键
共价键
③![]() 质量分数为
质量分数为![]() 的
的![]() ,加水至100mL,
,加水至100mL,![]() 的质量分数为
的质量分数为![]()
④标准状况下,![]() 四氯化碳含有的分子数为
四氯化碳含有的分子数为![]()
⑤![]() 时,
时,![]() 的
的![]() NaClO溶液中水电离出的
NaClO溶液中水电离出的![]() 的数目为
的数目为![]()
⑥![]() 溶液中含有
溶液中含有![]() 个
个![]()
⑦![]()
![]() 与水完全反应时转移电子数为
与水完全反应时转移电子数为![]()
A.③⑥⑦B.①②④C.①②⑤D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车安全气囊弹出时的反应为:![]() 下列说法正确的是( )
下列说法正确的是( )
A.自然界中氮、钠、硅元素均可以游离态形式存在
B.将反应后的固体溶于适量水,静置,通入![]() ,无现象
,无现象
C.微粒的半径:![]()
D.若反应中转移![]() 电子,则消耗
电子,则消耗![]() 的质量为
的质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CO(g)+2H2(g)![]() 2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是
2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是
组序号 | 1 | 2 | 3 | 4 | |
反应温度/℃ | 225 | 235 | 225 | 235 | |
反应前气体的物质的量/mol | CO2 | 0 | 0 | 0.2 | 0.2 |
CO | 3.0 | 3.0 | 2.8 | 2.8 | |
H2 | 7.0 | 7.0 | 7.0 | 7.0 | |
平衡时CH3OH的体积分数/% | 4.9 | 8.8 | 36.5 | 50.7 | |
A.该反应的△H>0
B.当容器中压强不变时,反应达到平衡
C.CH3OH含量增大的原因是CO2
D.少量CO2能提高平衡时CH3OH的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是重要的有机中间体,利用二氧化碳加氢合成二甲醚能变废为宝,且可替代汽油作为新型清洁燃料。常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H1=﹣55.7kJ/mol
②2CH3OH(l)═CH3OCH3(g)+H2O(l)△H2=﹣23.4kJ/mol
③CO2(g)+H2(g)═CO(g)+H2O(l) △H3
④H2O(l)=H2O(g) △H4=+44.0kJ/mol
(1)已知反应CO2(g)+H2(g)=CO(g)+H2O(g)△H,中相关的化学键键能数据如下:

由此计算△H=______,则△H3=_______。
(2)CO2(g)加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式是___。
(3)合成二甲醚往往选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如图所示,图中A点和B点的平衡常数比较:KA___KB(填“>、=、<”)。根据以上两条曲线,写出其中一条变化规律:a.___。b.___。
(4)常温常压下,向一个2.00L的密闭恒容容器中加入等量2.00mol二氧化碳和氢气,平衡时二甲醚的浓度为0.150mol/L,计算此时二氧化碳的转化率及该反应的平衡常数,要求写出计算过程(计算结果保留3位有效数字)________、_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
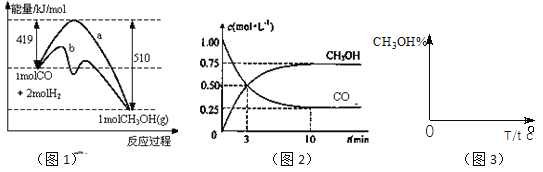
请回答下列问题:
(1)在“图1”中,曲线___(填:a或b)表示使用了催化剂;该反应属于_____(填:吸热、放热)反应。
(2)下列说法正确的是_____
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时
n(CH3OH)/n(CO)会减小
(3)从反应开始到建成平衡, v(H2)=________;已知:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,那么在该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线________(在曲线上标出P1、P2,且P1<P2)。
(5) 有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g)![]() xC(g)ΔH未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
xC(g)ΔH未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)

A.P3>P4,y轴表示C的转化率
B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的密度
D.P3>P4,y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL![]() 的NaOH溶液吸收标准状况下
的NaOH溶液吸收标准状况下![]()
![]() 时,所得溶液中各离子浓度由大到小的顺序为______
时,所得溶液中各离子浓度由大到小的顺序为______
(2)常温下向一定体积的![]() 醋酸溶液中加水稀释后,下列说法正确的是______.
醋酸溶液中加水稀释后,下列说法正确的是______.
A.溶液中导电粒子的数目减少 ![]() 醋酸的电离程度增大,
醋酸的电离程度增大,![]() 亦增大
亦增大
C.溶液中 不变
不变 ![]() 溶液中
溶液中 减小
减小
(3)①常温下将![]() 稀硫酸
稀硫酸![]() 与
与![]() NaOH溶液
NaOH溶液![]() mL棍合,所得溶液的pH为1,则
mL棍合,所得溶液的pH为1,则![]() :
:![]() ______
______![]() 溶液体积变化忽略不询.
溶液体积变化忽略不询.
②常温下若溶液由![]() 的HA溶液
的HA溶液![]() 与
与![]() 的NaOH溶液
的NaOH溶液![]() 混合而得,则下列说法正确的是______
混合而得,则下列说法正确的是______
A.若反应后溶液呈中性,则![]()
B.若![]() ,反应后溶液pH一定等于7
,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则![]() 一定大于
一定大于![]()
D.若反应后溶液呈碱性,则![]() 一定小于
一定小于![]()
(4)常温下,浓度均为![]() 的下列五种溶液的pH值如下表所示:
的下列五种溶液的pH值如下表所示:
溶质 |
|
|
| NaClO | NaCN |
pH |
|
|
|
|
|
①根据表中数据,将浓度均为![]() 的下列四种酸的溶液分别稀释100倍,pH变化最小的是______
的下列四种酸的溶液分别稀释100倍,pH变化最小的是______
A.HCN![]()
![]()
![]()
②根据以上数据,判断下列反应可以成立的是______.
A.![]()
![]()
C.![]()
![]()
(5)几种离子开始沉淀时的pH如下表:
离子 |
|
|
|
pH |
|
|
|
当向含相同浓度![]() 、
、![]() 、
、![]() 离子的溶液中滴加NaOH溶液时,______
离子的溶液中滴加NaOH溶液时,______![]() 填离子符号
填离子符号![]() 先沉淀,
先沉淀,![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com