
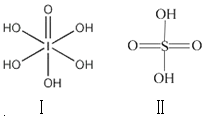
 已知硫酸(H2SO4)和高碘酸(H5IO6)的结构分别如图I、II所示:请从结构角度比较二者酸性强弱:H2SO4>H5IO6(填“>”、“<”或“=”).
已知硫酸(H2SO4)和高碘酸(H5IO6)的结构分别如图I、II所示:请从结构角度比较二者酸性强弱:H2SO4>H5IO6(填“>”、“<”或“=”).  小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
 表中表示的一些物质或概念间的从属关系中不正确的是( )
表中表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | ||
| 例 | 氧化物 | 化合物 | 纯净物 | |
| A | 苯的同系物 | 芳香烃 | 芳香化合物 | |
| B | 烯烃 | 不饱和烃 | 烃 | |
| C | 氯乙烷 | 卤代烃 | 烃的衍生物 | |
| D | 羰基 | 羧基 | 酯基 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将湿润的红色石蕊试纸放在打开的瓶口 | |
| B. | 将湿润的蓝色石蕊试纸放在打开的瓶口 | |
| C. | 用蘸有浓硫酸的玻璃棒靠近打开的瓶口. | |
| D. | 将干燥的红色石蕊试纸放在瓶口 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质的量/时间 | n(N2H4) | n(NO2) | n(N2) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.3 |
| 第5min | 0.4 | 1.2 | 0.6 |
| 第6min | 0.4 | 1.2 | 0.6 |
| 第10min | 0.6 | 1.4 | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

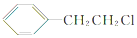 ,B的名称为苯乙烯.
,B的名称为苯乙烯.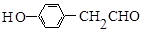 .
.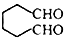 (1,6-己二醛)的合成路线.
(1,6-己二醛)的合成路线.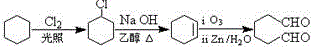
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
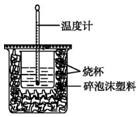 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当生成的沉淀量达到最大时,消耗NaOH 溶液的体积V≥100 mL | |
| B. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是 0.4 mol | |
| C. | 参加反应的金属的总质量 9.6g>m>3.6g | |
| D. | 当金属全部溶解时收集到 NO气体的体积一定为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com