
| A. | F | B. | Cl | C. | O | D. | Na |
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4含有NA个分子 | |
| B. | 0.2 mol•L-1 Na2S溶液中含有的S2-数目小于0.2NA | |
| C. | 18gD2O中含有的质子数为10NA(相对原子质量D:2,O:16) | |
| D. | 1molNa与足量的O2反应,钠失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
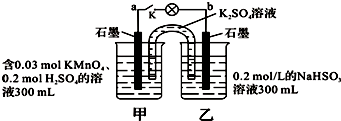
| A. | 当电路中有1.204×1022个电子转移时,乙烧杯中溶液的C(H+)约为0.1 mol•L-1 | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯 | |
| C. | 电池工作时,外电路的电子方向是从a到b | |
| D. | 乙池中的氧化产物为SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
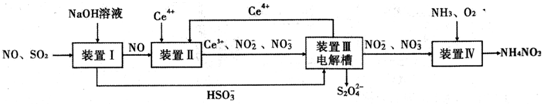
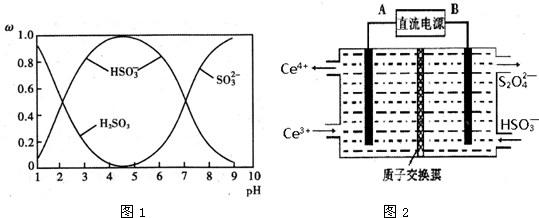
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
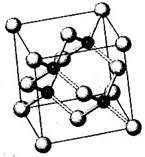 N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题:
N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若b的最高价氧化物对应水化物为H2bO4,则a的氢化物的化学式为aH3 | |
| B. | 若b的单质可作半导体材料,则c的单质不可能为半导体材料 | |
| C. | 若b的单质与H2易化合,则c的单质与H2更易化合 | |
| D. | a与b之间容易形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 器材和试剂 | 相应实验 |
| A | 洗气瓶,饱和Na2CO3溶液、浓硫酸、含HCl和水蒸气的CO2气体 | 除去CO2中的HCl和水蒸气 |
| B | 分液漏斗、烧杯、蒸馏水、溴和苯的混合物 | 分离溴和苯的混合物 |
| C | 铁架台、试管、带导管的单孔塞、浓硫酸、铜片 | 实验室制取SO2 |
| D | 铁架台、试管、带导管的单孔塞、棉花、酒精灯、氯化铵晶体、熟石灰 | 实验室制取NH3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com