
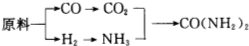
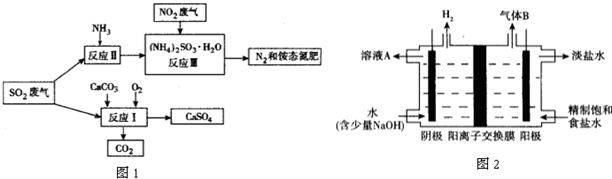
分析 (1)温度影响化学反应速率及化学平衡;工业生产中,以氨气为原料合成硝酸,是先将氨催化氧化生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,据此写化学方程式;
(2)用原料所制得的H2和CO2的物质的量之比若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,原料的利用率最高,根据原料气产生的H2和CO2的物质的量之比判断;
(3)①根据反应物和生成物,写出反应Ⅰ的化学方程式;
②加入强还原性的对苯二酚等物质,目的是防止亚硫酸铵(NH4)2SO3被氧化;
③检验SO42-所用试剂是盐酸和氯化钡;
(4)①二氧化硫和氢氧化钠反应生成NaHSO3;
②阳极区产生的气体氯气的溶液与二氧化硫发生氧化还原反应.
解答 解:(1)合成氨反应的化学方程式为:N2(g)+3H2(g)$\frac{催化剂}{高温高压}$2NH3(g)△H=-92.2kJ/mol,在400~500℃的高温时,催化剂的催化活性最强,同时升高温度虽然不利于平衡向正反应方向移动,但能增大反应速率,缩短达到平衡的时间;工业生产中,以氨气为原料合成硝酸,是先将氨催化氧化生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,所以工业生产硝酸的最后一步的化学方程式为3NO2+H2O=2HNO3+NO,
故答案为:催化活性最强,增加反应速率,缩短达到平衡的时间; 3NO2+H2O=2HNO3+NO;
(2)NH3(换算成H2的物质的量)和CO2的物质的量之比为2:1合成尿素,即H2和CO2的物质的量之比为$\frac{2×3}{2}$:1=3:1.
甲厂以焦炭和水为原料,C+2H2O$\frac{\underline{\;高温\;}}{\;}$CO2+2H2,生成的H2和CO2的物质的量之比为2:1.
乙厂以天然气和水为原料,CH4+2H2O$\frac{\underline{\;高温\;}}{\;}$CO2+4H2,生成的H2和CO2的物质的量之比为4:1.
丙厂以石脑油和水为原料,C5H12+10H2O$\frac{\underline{\;高温\;}}{\;}$5CO2+16H2,生成的H2和CO2的物质的量之比为16:5,丙最接近3:1,
故答案为:丙;
(3)①根据反应物和生成物,写出反应Ⅰ的化学方程式为:2CaCO3+O2+2SO2=2CaSO4+2CO2,
故答案为;2CaCO3+O2+2SO2=2CaSO4+2CO2;
②亚硫酸根离子易被氧化,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是防止亚硫酸铵(NH4)2SO3被氧化,
故答案为:防止亚硫酸铵(NH4)2SO3被氧化;
③检验SO42-所用试剂是盐酸和氯化钡(HCl 和 BaCl2),
故答案为:盐酸和氯化钡(HCl 和 BaCl2);
(4)①二氧化硫和氢氧化钠反应生成NaHSO3,SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O),
故答案为:SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O);
②阳极区产生的气体氯气的溶液与二氧化硫发生氧化还原反应,SO2+Cl2+2H2O=4H++SO42-+2Cl-,
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-.
点评 本题考查了影响化学反应速率的因素,化学方程式的计算,离子反应等,考查的知识点较多,结合性强,题目难度中等,试题能够提高学生的分析、理解能力及计算能力.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:多选题
| A. | 锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 | |
| B. | 常温下pH都等于5的CH3COOH溶液和NH4Cl溶液中,水的电离程度前者比后者大 | |
| C. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 | |
| D. | 0.1 mol•L-1CH3COOH溶液加水稀释后,c(OH-)、CH3COOH的电离程度均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
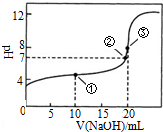 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 点①所示溶液中:c(CH3COOH)+c(CH3COO-)>2c(Na+) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 点③所示溶液中:c(CH3COO-)>c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3水解:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用石墨作电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 乙醛与新制的Cu(OH)2悬浊液加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验淀粉是否发生水解,将淀粉与稀硫酸溶液共热,冷却后,取上层水溶液,用NaOH中和稀硫酸后,再加入Cu(OH)2悬浊液,加热,观察是否产生砖红色沉淀 | |
| B. | 检验Fe(NO3)2晶体是否已氧化变质,将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变血红色 | |
| C. | 在酸、碱中和滴定终点时不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量溶液进行调整 | |
| D. | 实验室制备氢氧化亚铁,滴加氢氧化钠溶液时应将胶头滴管插入硫酸亚铁溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com