
【题目】将Al条插入6 mol·L-1盐酸中,反应过程中产生H2速率变化情况如图1所示。下列说法错误的是
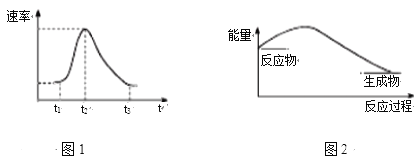
A. 图1中开始阶段产生气体速率较慢可能是因为Al条表面有氧化膜
B. 图1中影响t1~t2段速率变化的主要原因是反应放热导致溶液温度升高
C. 图1中影响t2~t3速率变化的主要因素是c(Cl-)
D. 图2可以表示该反应过程的能量变化
【答案】C
【解析】
图1反应速率与表面积大小、温度、浓度有关,t2之前反应速率与温度升高有关,t2之后反应速率与浓度减小有关。图2,该反应是放热反应,能量变化是反应物的总能量高于生成物的总能量;
A、图1中开始阶段产生气体速率较慢可能是因为Al条表面有氧化膜,氧化膜与酸反应时没有氢气产生,故A正确;
B、图1中影响t1~t2段速率变化的主要原因是反应放热,导致溶液温度升高,故B正确;
C、t2后随反应进行,2Al+6H+=2Al3++3H2↑,氢离子浓度不断减小,影响反应速率的主要因素是氢离子浓度减小,故C错误;
D、该反应是放热反应,能量变化是反应物的总能量高于生成物的总能量,所以图2符合,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下,下列说法不正确的是

A. NH4ClO4属于离子化合物
B. 溶解度: NaClO4> NH4ClO4
C. 电解NaClO3溶液时阳极反应式为ClO3—+H2O-2e-===C1O4—+2H+
D. 该流程中可循环利用的物质是NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl![]() 和AlCl
和AlCl![]() 组成的离子液体作电解液时,可在钢制品上电镀铝。
组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
a.KCl b.KClO3c.MnO2d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是___________________(用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物异搏定路线中某一步骤如下:

下列说法正确的是
A. 化合物Z可以发生取代、加成、氧化、加聚反应
B. 1mol化合物Y最多与1molNaOH发生反应
C. 化合物Y中所有原子可能在同一平面内
D. 可以用NaOH溶液检验化合物Z中有没有残留的化合物X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解热镇痛药扑炎痛可由化合物X、Y在一定条件下反应合成。下列有关叙述正确的是

A. 扑炎痛的分子式为C17H16NO5
B. 可用FeCl3溶液检验扑炎痛中是否含有化合物Y
C. 扑炎痛在酸性条件下水解最终可以得到4种物质
D. 与化合物X互为同分异构体且属于二元羧酸的化合物有10种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。下列叙述错误的是( )


A. 电池应选用阳离子交换膜,Na+向A极区移动
B. 电池A极区的电极反应式为:H2O2+2e-=2OH-
C. 每有1molNaBH4参加反应,转移电子数为4NA
D. 要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com