
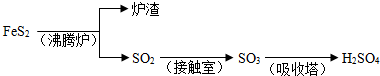
��1����֪:
Fe��s��+1/2O2��g��=FeO��s�� ![]()
2Al��s��+3/2O2��g��= Al2O3��s�� ![]()
Al��FeO�������ȷ�Ӧ���Ȼ�ѧ����ʽ��
_____________________________________________________��
��2����Ӧ�����������Ϊ��̬��ij���淴Ӧ�ڲ�ͬ�����µķ�Ӧ���̷ֱ�ΪA��B������ͼ��ʾ��
�پ�ͼ�жϸ÷�Ӧ��_____(������š�) �ȷ�Ӧ������Ӧ�ﵽƽ��
 �������������䣬�����¶ȣ���Ӧ���ת����__ _
�������������䣬�����¶ȣ���Ӧ���ת����__ _
(���������С�����䡱)
������B���̱����˷�Ӧ���õ�����Ϊ______ (ѡ������
�����ĸ)
A�������¶� B������Ӧ���Ũ��
C�������¶� D��ʹ���˴���
��3��1000��ʱ���������������������з�Ӧ��Na2SO4(s) + 4H2(g) ![]() Na2S(s) + 4H2O(g) ��
Na2S(s) + 4H2O(g) ��
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ____________________����֪K1000����K1200������÷�Ӧ��________��Ӧ������ȡ����ȡ�����
�����й����ӷ���ʽ˵��������Ӧ���ù�������ˮ��Һ�������_______ _____
��4�������£����ȡ0.1mol��L��1HA��Һ��0.1mol��L��1NaOH��Һ�������ϣ���Ϻ���Һ����ı仯���Բ��ƣ�����û��Һ��pH��8����ش��������⣺
�ٻ����Һ��ˮ�������c(H��)��0.1mol��L��1NaOH��Һ��ˮ�������c(H��)�Ƚ�
���������������
����֪NH4A��ҺΪ���ԣ���֪��HA��Һ�ӵ�Na2CO3��Һ��������ų������ƶ�(NH4)2CO3��Һ��pH 7�����������������ͬ�¶��£������ʵ���Ũ�ȵ���������Һ��pH�ɴ�С������˳��Ϊ ��������ţ�
a.��NH4HCO3 b��NH4A c��(NH4)2CO3 d��NH4Cl

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| �ŵ� | ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| ||
| �� |
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
| ||
| ���� |
| Ũ���� |
| Ũ���� |
| ��м |
| ���� |
| ���� |
| Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�����ʡ�����б�ҵ��������飨һ����ѧ�Ծ��������棩 ���ͣ������
��1����֪����Fe(s)+1��2O2(g)=FeO(s) ��H1=-272.0KJ��mol-1
��2Al(s)+3��2(g)=Al2O3(s) ��H2=-1675.7KJ��mol-1
Al��FeO�������ȷ�Ӧ���Ȼ�ѧ����ʽ��__ __��
ijͬѧ��Ϊ�����ȷ�Ӧ�����ڹ�ҵ����������ж���_ (��ܡ����ܡ�)���������

��2����Ӧ�����������Ϊ��̬��ij���淴Ӧ�ڲ�ͬ�����µķ�Ӧ���̷ֱ�ΪA��B����ͼ��ʾ���پ�ͼ�жϸ÷�Ӧ�� (������š� )�ȷ�Ӧ������Ӧ�ﵽƽ��������������䣬�������¶ȣ���Ӧ���ת���ʽ� (����� ����С�����䡱)��
������B���̱����˷�Ӧ���õ�����Ϊ
(����ĸ)��
A.�����¶� B.����Ӧ���Ũ��
C.�����¶� D.ʹ�ô���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��㶫ʡ�����г������ɲ���ѧ�߶����ϣ����л�ѧ�Ծ��������棩 ���ͣ������
 O2��g��=FeO��s����H=-272.0kJ?mol-1
O2��g��=FeO��s����H=-272.0kJ?mol-1 O2��g��=Al2O3��s����H=-1675.7kJ?mol-1
O2��g��=Al2O3��s����H=-1675.7kJ?mol-1�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com