
【题目】大力发展电动汽车,可以有效控制空气污染.目前机动车常使用的电池有铅蓄电池、锂电池等.
Ⅰ![]() 铅蓄电池充放电的总反应为:
铅蓄电池充放电的总反应为:![]()
![]()
![]() ,锂硫电池充放电的总反应为:
,锂硫电池充放电的总反应为:![]()
![]()
![]() .
.
![]() 放电时,铅蓄电池的负极反应式为 ______ .
放电时,铅蓄电池的负极反应式为 ______ .
![]() 锂硫电池工作时,电子经外电路流向 ______
锂硫电池工作时,电子经外电路流向 ______ ![]() 填“正极”或“负极”
填“正极”或“负极”![]() .
.
![]() 当消耗相同质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ______ 倍.
当消耗相同质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ______ 倍.
Ⅱ![]() 由方铅矿
由方铅矿![]() 制备铅蓄电池电极材料
制备铅蓄电池电极材料![]() 的方法如下:
的方法如下:

![]() 油画所用的白色颜料
油画所用的白色颜料![]() 置于空气中,遇
置于空气中,遇![]() 气体变成黑色PbS,从而使油画的色彩变暗,用
气体变成黑色PbS,从而使油画的色彩变暗,用![]() 清洗,可使油画“复原”.
清洗,可使油画“复原”.
![]() 的作用是 ______.
的作用是 ______.
![]() 已知硫化铅溶于水时存在溶解平衡:
已知硫化铅溶于水时存在溶解平衡:![]() ,试分析
,试分析![]() 能溶于稀
能溶于稀![]() 的原因 ______.
的原因 ______.
![]() 滤液X是一种可循环使用的物质,其溶质主要是 ____
滤液X是一种可循环使用的物质,其溶质主要是 ____ ![]() 填化学式
填化学式![]() ,若X中残留的
,若X中残留的![]() 过多,循环使用时可能出现的问题是 ____.
过多,循环使用时可能出现的问题是 ____.
![]() 与次氯酸钠溶液反应可制得
与次氯酸钠溶液反应可制得![]() ,写出该反应的离子方程式 ______ .
,写出该反应的离子方程式 ______ .
![]() 以石墨为电极,电解
以石墨为电极,电解![]() 溶液也可以制得
溶液也可以制得![]() ,则阳极的电极反应式为 ______ ;电解时为提高Pb元素的利用率,常在
,则阳极的电极反应式为 ______ ;电解时为提高Pb元素的利用率,常在![]() 溶液中加入适量
溶液中加入适量![]() ,理由是 ______ .
,理由是 ______ .
【答案】![]() 正极 14.8 氧化剂 硝酸氧化硫离子导致硫离子的浓度减小,使溶解平衡正向移动,促进PbS的溶解
正极 14.8 氧化剂 硝酸氧化硫离子导致硫离子的浓度减小,使溶解平衡正向移动,促进PbS的溶解 ![]() 浸出时部分铅离子生成硫酸铅随浸出渣排出,降低硫酸铅的产率
浸出时部分铅离子生成硫酸铅随浸出渣排出,降低硫酸铅的产率 ![]()
![]() 加入硝酸铜,铜离子在阴极放电生成单质铜,避免了铅离子在阴极放电,增大铅离子的利用率
加入硝酸铜,铜离子在阴极放电生成单质铜,避免了铅离子在阴极放电,增大铅离子的利用率
【解析】
Ⅰ.(1)放电时,铅蓄电池的负极发生氧化反应;
(2)原电池工作时电子由负极流向正极;
(3)铅蓄电池中207g铅消耗时转移 2mol e-,锂硫电池中7g锂消耗时转移1mol电子;
Ⅱ.PbS和硝酸发生氧化还原反应生成Pb(NO3)2和硫单质或硫酸,同时产生NOx,溶液中加入硫酸溶液,生成PbSO4沉淀和HNO3溶液,HNO3可以循环利用。PbSO4中加入碳酸钠溶液,PbSO4转化为PbCO3,PbCO3可以受热分解成PbO,PbO被NaClO氧化为PbO2。
Ⅰ(1)放电时,铅蓄电池的负极发生氧化反应,而铅离子与溶液中的硫酸根离子生成难溶的硫酸铅,电极反应式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)原电池工作时电子由负极流向正极,故答案为:正极;
(3)铅蓄电池中铅是负极,207g铅消耗时转移 2mol ![]() ,故锂硫电池的理论放电量是铅蓄电池的:
,故锂硫电池的理论放电量是铅蓄电池的:![]() 倍,故答案为:
倍,故答案为:![]() ;
;
Ⅱ(1)①过氧化氢将黑色PbS氧化成白色的硫酸铅,所以过氧化氢是氧化剂,故答案为:氧化剂;
②已知硫化铅溶于水时存在溶解平衡:![]() ,电离产生的硫离子具有还原性,而硝酸具有强氧化性,发生氧化还原反应,导致硫离子的浓度减少,固平衡正向移动,故答案为:硝酸氧化硫离子导致硫离子的浓度减小,使溶解平衡正向移动,促进PbS的溶解;
,电离产生的硫离子具有还原性,而硝酸具有强氧化性,发生氧化还原反应,导致硫离子的浓度减少,固平衡正向移动,故答案为:硝酸氧化硫离子导致硫离子的浓度减小,使溶解平衡正向移动,促进PbS的溶解;
(2)硝酸铅与硫酸发生复分解反应生成难溶硫酸铅和硝酸;残留的![]() 过多,会与溶液中的铅离子结合成难溶的硫酸铅,导致铅的流失,减少了二氧化铅的产量,故答案为:
过多,会与溶液中的铅离子结合成难溶的硫酸铅,导致铅的流失,减少了二氧化铅的产量,故答案为:![]() ;浸出时部分铅离子生成硫酸铅随浸出渣排出,降低硫酸铅的产率;
;浸出时部分铅离子生成硫酸铅随浸出渣排出,降低硫酸铅的产率;
(3)①![]() 和次氯酸钠反应生成二氧化铅和氯化钠,离子方程式为
和次氯酸钠反应生成二氧化铅和氯化钠,离子方程式为![]() ;故答案为:
;故答案为:![]() ;
;
![]() 电解时,阳极上铅离子失电子和水反应生成二氧化铅,电极反应式为
电解时,阳极上铅离子失电子和水反应生成二氧化铅,电极反应式为![]() ;加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子放电,从而大大提高铅离子的利用率,故答案为:
;加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子放电,从而大大提高铅离子的利用率,故答案为: ![]() ,加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子在阴极放电,增大铅离子的利用率。
,加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子在阴极放电,增大铅离子的利用率。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】实验室用硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]滴定法测定铬铁矿中铬含量的过程如下:
酸溶:准确称取0.1950 g铬铁矿试样放入锥形瓶中,加入适量磷酸和硫酸的混合酸,加热使试样完全溶解,冷却。
氧化:向上述溶液中滴加5滴1%的MnSO4溶液,再加入一定量的过硫酸铵[(NH4)2S2O8]溶液,摇匀,加热煮沸至出现紫红色,继续加热煮沸至紫红色褪去,冷却。[已知:①2Mn2+ + 5S2O82- + 8H2O = 10SO42- + 2MnO4- + 16H+;②继续加热煮沸后,溶液中过量(NH4)2S2O8和生成的HMnO4已分解除去]
滴定:用0.2050mol·L-1(NH4)2Fe(SO4)2标准溶液滴定上述溶液至终点,消耗19.50 mL标准溶液。(已知:Cr2O72-![]() Cr3+)
Cr3+)
(1)过硫酸铵保存在棕色试剂瓶中的原因是___________。
(2)①“氧化”的目的是将试样溶液中的Cr3+氧化成Cr2O72-,加入5滴MnSO4溶液的目的是________________(已知该条件下还原性:Cr3+ > Mn2+)。
②“氧化”过程中,如果继续加热煮沸时间不充足,会使铬含量的测定结果______(填“偏大”“不变”或“偏小”)。
(3)计算铬铁矿中铬的质量分数(写出计算过程)。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下物质为铁及其化合物之间的相互转化:
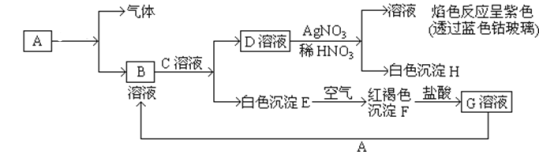
试回答:
(1)写出D的化学式___,H的化学式___。
(2)鉴别G溶液的试剂为___。
(3)写出由E转变成F的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茅台酒中存在少量具有凤梨香味的物质X,其结构如图所示。下列说法正确的是

A. X难溶于乙醇
B. 酒中的少量丁酸能抑制X的水解
C. 分子式为C4H8O2且官能团与X相同的物质有5种
D. X完全燃烧后生成CO2和H2O的物质的量比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池可长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为Fe(OH)3-3e-+5OH-=FeO![]() +4H2O
+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H、I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:
(1)B单质分子中![]() 与
与![]() 键数目比为____。B、C、D第一电离能由小到大的顺序为________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为________(填写元素符号)。
(2)H元素原子的价层电子排布式为____,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色的络合物;该阴离子又与A—I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为______(写一种即可),该分子中心原子轨道的杂化类型为_______,该阴离子空间构型为_______。
(3)D与G可以形成如图的晶胞,则黑点表示的是元素_______(填写元素符号),该元素原子在该晶胞中的配位数为______。
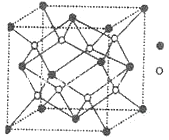
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计正确的是( )
操作 | 现象 | 结论 | |
A | 将SO2通入溴水 | 溴水褪色 | SO2具有漂白性 |
B | 将乙烯通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 乙烯具有还原性 |
C | 将澄清石灰水滴入某溶液 | 出现白色浑浊 | 其溶液中存在CO32- |
D | 将硝酸银溶液滴入某溶液 | 出现白色沉淀 | 其溶液中存在Cl- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁的工艺流程可表示如下:
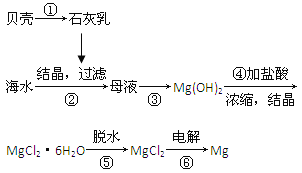
下列说法不正确的是( )。
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2时阴极产生氯气
C.步骤⑤可将晶体置于HCl气体氛围中脱水
D.上述工艺流程中涉及化合、分解和复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是![]() ,含
,含![]() 、
、![]() 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:

请回答下列问题:
(1)流程乙加入烧碱后的离子方程式为_________________________________________.
(2)固体A的应用_________________________________________.(两点)
(3)滤液D与少量CO2反应的离子方程式为__________________________________,
向该滤液K中加入足量石灰水的离子方程式是________
(4)流程乙制氧化铝的优点是所用的试剂较经济,缺点是__________________________
(5)已知298K时,![]() 的溶度积常数
的溶度积常数![]() =10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的pH最小为_______.
=10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的pH最小为_______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com