
| A.S | B.C | C.KNO3 | D.S 、KNO3 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 +2e-
+2e- 2SO
2SO ,该反应中另一重要反应物可能是KMnO4、Na2CO3、MnSO4、KNO3四种物质中的一种。下列有关说法正确的是( )
,该反应中另一重要反应物可能是KMnO4、Na2CO3、MnSO4、KNO3四种物质中的一种。下列有关说法正确的是( )A.S2O 中S显+7价,说明S的最外层有7个电子 中S显+7价,说明S的最外层有7个电子 |
| B.该反应中另一重要反应物为KMnO4 |
C.该反应的氧化过程可表示为:Mn2+-5e-+4H2O MnO MnO +8H+ +8H+ |
D.若有5mol S2O 参与反应,溶液中会生成8 mol H+ 参与反应,溶液中会生成8 mol H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化性:A2 >B2>C2 >D2 | B.还原性:C->A->B->D- |
| C.2A-+D2 =2D-+A2该反应可以进行 | D.2C-+B2 =2B-+C2该反应也能进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2既是氧化产物又是还原产物 |
| B.CuFeS2既是氧化剂又是还原剂 |
| C.O2只做氧化剂 |
| D.若有1mol O2参加反应,则反应中有4mol电子转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 _____ __是还原剂;若反应中有1.5mol氧化剂参与反应,则发生转移的电子的物质的量为______ _mol,被氧化的物质有 mol。
_____ __是还原剂;若反应中有1.5mol氧化剂参与反应,则发生转移的电子的物质的量为______ _mol,被氧化的物质有 mol。 是因为发生如下2个反应:
是因为发生如下2个反应:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀)
铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀) O
O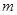 。
。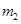 。
。 使之溶解,
使之溶解, 得晶体质量为
得晶体质量为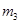 。
。| A.纯碱溶液 | B.烧碱溶液 | C.明矾溶液 | D.稀硫酸 |
 (碱式硫酸铁),该反应的化学方程式为 。
(碱式硫酸铁),该反应的化学方程式为 。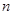 H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。 晶体的产率为
晶体的产率为  。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.消耗硫酸亚铁铵的物质的量为n(2-x)mol |
| B.处理废水中Cr2O72- 的物质的量为mol |
| C.反应中发生转移的电子数为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com