
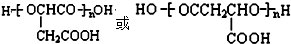 .
. 分析 苹果酸(MLA)分子式为C4H6O5,0.l mol苹果酸与足量NaHCO3溶液反应能产生4.48L CO2(标准状况),二氧化碳的物质的量为0.2mol,则1mol苹果酸含2mol-COOH.苹果酸脱水能生成使溴水褪色的产物,应含有1个-OH,结合苹果酸的分子式知,苹果酸的结构简式为:HOOCCH2CH(OH)COOH.苹果酸酯化反应进行的聚合生成聚苹果酸(PMLA),其结构为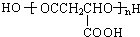 .
.
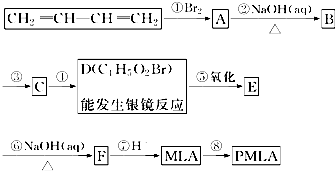
D被氧化生成E,则E中含有溴原子,E和氢氧化钠的水溶液发生反应生成F,F酸化生成MLA,所以F的结构简式为:NaOOCCH2CH(OH)COONa,E的结构简式为:HOOCCH2CHBrCOOH,D能发生银镜反应则D中含有醛基,所以D的结构简式为:OHCCH2CHBrCHO,根据1,3-丁二烯及D的结构简式知,1,3-丁二烯和溴发生1,4-加成生成A为BrCH2CH=CHCH2Br,A和氢氧化钠的水溶液发生取代反应生成B为HOCH2CH=CHCH2OH,B与HBr发生加成反应生成C,C的结构简式为:HOCH2CH2CHBrCH2OH,C再被氧化生成D,苹果酸经聚合生成聚苹果酸(PMLA),据此解答.
解答 解:苹果酸(MLA)分子式为C4H6O5,0.l mol苹果酸与足量NaHCO3溶液反应能产生4.48L CO2(标准状况),二氧化碳的物质的量为0.2mol,则1mol苹果酸含2mol-COOH.苹果酸脱水能生成使溴水褪色的产物,应含有1个-OH,结合苹果酸的分子式知,苹果酸的结构简式为:HOOCCH2CH(OH)COOH.苹果酸酯化反应进行的聚合生成聚苹果酸(PMLA),其结构为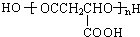 .
.
D被氧化生成E,则E中含有溴原子,E和氢氧化钠的水溶液发生反应生成F,F酸化生成MLA,所以F的结构简式为:NaOOCCH2CH(OH)COONa,E的结构简式为:HOOCCH2CHBrCOOH,D能发生银镜反应则D中含有醛基,所以D的结构简式为:OHCCH2CHBrCHO,根据1,3-丁二烯及D的结构简式知,1,3-丁二烯和溴发生1,4-加成生成A为BrCH2CH=CHCH2Br,A和氢氧化钠的水溶液发生取代反应生成B为HOCH2CH=CHCH2OH,B与HBr发生加成反应生成C,C的结构简式为:HOCH2CH2CHBrCH2OH,C再被氧化生成D,苹果酸经聚合生成聚苹果酸(PMLA).
(1)由上述分析可知,B为HOCH2CH=CHCH2OH,D为OHCCH2CHBrCHO,含有官能团有:醛基、溴原子,
故答案为:HOCH2CH=CHCH2OH;醛基、溴原子;
(2)MLA为HOOCCH2CH(OH)COOH,核磁共振氢谱有5组峰,任意一种与MLA具有相同官能团的同分异构体的结构简式为:HOOCC(OH)(CH3)COOH 或HOOCCH(CH2OH)COOH,
故答案为:5;HOOCC(OH)(CH3)COOH 或HOOCCH(CH2OH)COOH;
(3)E→F转化的化学方程式为:HOOCCH2CHBrCOOH+3NaOH$\stackrel{△}{→}$NaOOCCH2CH(OH)COONa+NaBr+2H2O,
故答案为:HOOCCH2CHBrCOOH+3NaOH$\stackrel{△}{→}$NaOOCCH2CH(OH)COONa+NaBr+2H2O;
(4)顺序不能颠倒,若先氧化则B中碳碳双键也被氧化,
故答案为:不能,若先氧化则B中碳碳双键也被氧化;
(5)苹果酸经聚合生成聚苹果酸(PMLA),PMLA的可能结构简式为: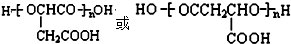 ,
,
故答案为: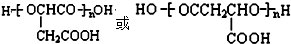 .
.
点评 本题考查有机物的推断,明确苹果酸的性质来推断其结构是解答本题的关键,熟悉醇、羧酸、烯烃的性质即可解答,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | C-C | C═C | C-H | H-H |
| 键能/(kJ•mol-1) | 348 | 610 | 413 | 436 |
 (g)+3H2(g)→
(g)+3H2(g)→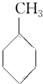 (g)的反应热;
(g)的反应热;| A. | ①②③④ | B. | ③④⑤ | C. | ④⑤ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵和过氧化氢的分解 | B. | 二氧化硅与二氧化碳的熔化 | ||
| C. | 蔗糖和干冰的熔化 | D. | 氯化镁和氯化铝的熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取25g胆矾溶解在1L水中 | |
| B. | 将16g胆矾溶于水,然后将此溶液稀释至1L | |
| C. | 称取25g胆矾溶于水,然后将此溶液稀释至1L | |
| D. | 将胆矾加热除去结晶水后,称取16g溶解在1L水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取代 加成 水解 | B. | 消去 加成 水解 | C. | 水解 消去 加成 | D. | 消去 水解 取代 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com