
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNaOD溶于重水制成1L溶液,pD=13 | |
| B. | 将pD=4的DCl的重水溶液稀释100倍,所得溶液pD不等于6 | |
| C. | 向30mL0.5mol•L-1NaOD的重水溶液中加入20mL0.5mol•L-1DCl的重水溶液,所得溶液pD=11 | |
| D. | pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
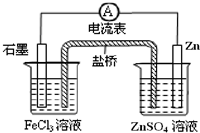 根据下列原电池示意图,回答下列问题:
根据下列原电池示意图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ②④⑥ | C. | ③⑦⑧ | D. | ③⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
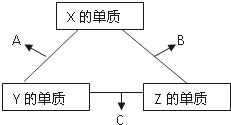 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计 | 实验目的 |
| A | 分别取大小相近的钠粒、钾粒投入水中,观察反应的剧烈程度 | 比较钠、钾元素的金属性强弱 |
| B | 将两块相同的铝片放入不同浓度的稀盐酸中,观察产生气泡的速率 | 验证H+的浓度是影响反应速率的唯一因素 |
| C | 将少量溴水加入碘化钾溶液中,再加入CCl4,振荡,静置,观察CCl4层颜色 | 比较溴单质和碘单质的氧化性性强弱 |
| D | 向硅酸钠溶液中加入稀硫酸,观察是否有 沉淀生成 | 比较硫元素和硅元素的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com