
| A、进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱 | ||
| B、HCl溶液的酸性比H2S溶液的酸性强,则Cl的非金属性比S强 | ||
C、2C+SiO2
| ||
| D、测定NaCl和NaF溶液的pH,可确定F、Cl两元素非金属性的强弱 |
| 高温 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
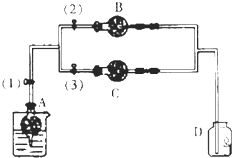 在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图所示连接.打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末变蓝;当打开活塞(1)(2)时,D中蜡烛火焰变得更明亮;关闭活塞(1)时,A中反应可自行停止.
在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图所示连接.打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末变蓝;当打开活塞(1)(2)时,D中蜡烛火焰变得更明亮;关闭活塞(1)时,A中反应可自行停止.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数为9 |
| B、电负性是所有元素中最大的 |
| C、原子半径是同周期元素中最小的 |
| D、第一电离能是所有元素中最大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
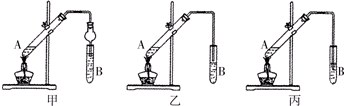
 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuO→Cu(OH)2 |
| B、Al2O3→Al(OH)3 |
| C、SiO2→H2SiO3 |
| D、Fe→FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
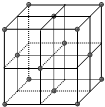 碳有多种同素异形体,常见的有金刚石,石墨,和C60(足球烯)分子,根据报道科研人员应用计算机模拟出结构类似C60的物质N60分子和Si60分子,
碳有多种同素异形体,常见的有金刚石,石墨,和C60(足球烯)分子,根据报道科研人员应用计算机模拟出结构类似C60的物质N60分子和Si60分子,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com