
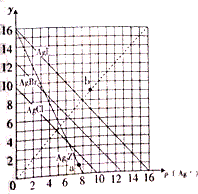
 卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )
卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )| A. | 该温度下Ag2Z的Ksp约为1×10-8 | |
| B. | a点可表示AgCl的过饱和溶液 | |
| C. | b点可表示AgI的过饱和溶液,且c(Ag+)=c(I-) | |
| D. | 该温度下AgCl、AgBr形成的混合溶液的饱和溶液中:c(Cl-)<c(Br-) |
分析 A.结合图象,依据Ksp(Ag2Z)=c2(Ag+)×c(Z2-)计算即可;
B.依据a点计算出AgCl的Qc与Ksp(AgCl)比较,若Qc>Ksp(AgCl),则此时溶液为饱和溶液;
C.b点银离子碘离子的浓度都需要饱和溶液时的浓度,为不饱和溶液;
D.依据图象得出此温度下,AgCl的溶解度大于AgBr的溶解度,据此判断浓度即可.
解答 解:A.依据图象得出此温度下,当Y=0,即Y=-lgc(Z2-)=0,即c(Z2-)=1时,p(Ag+)=-lgc(Ag+)=8,故Ksp(Ag2Z)=c2(Ag+)×c(Z2-)=(10-8)2×1=10-16,故A错误;
B.由图象得出此温度下,饱和AgCl溶液的Ksp(AgCl)=10-10,a点c(Ag+)>10-8:c(Cl-)=10-1,故AgCl的Qc=c(Cl-)×c(Ag+)>10-8•10-1=10-9>10-10,故a点为AgCl的过饱和溶液,故B正确;
C.纵横坐标越小实际离子的浓度越大,故b点为AgI的不饱和溶液,且c(Ag+)=c(I-),故C错误;
D.由于此温度下,Ksp(AgCl)>Ksp(AgBr),故溶液中c(Cl-)>c(Br-),故D错误;
故选B.
点评 本题主要考查难溶电解质的溶解平衡图象,充分理解图象并从图象中得出解题所需要的信息为解答关键,试题侧重考查学生的分析、理解能力,注意掌握难溶物溶解平衡及其影响、溶度积的概念及其应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 224 mL | B. | 336 mL | C. | 448 mL | D. | 672 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X可能是第二周期非金属元素 | B. | Y可能与X同主族 | ||
| C. | X可能是第三周期金属元素 | D. | Y一定是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 H++H2PO4-、H2PO4-
H++H2PO4-、H2PO4-  H++HPO42-、HPO42-
H++HPO42-、HPO42-  H++PO43-
H++PO43-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钠是漂粉精的主要成分 | |
| B. | 氧化钠可用于呼吸面具 | |
| C. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | Na2S04溶液 | AgN03溶液 | 现象 | ||
| 体积/mL | 浓度/(mol•L-1) | 体积/滴 | 浓度/(mol•L-1) | ||
| ① | 1 | l | 3 | 2 | 出现大量白色沉淀 |
| ② | 1 | 1 | 3 | 0.5 | 出现少量白色沉淀 |
| ③ | 1 | 1 | 3 | 0.1 | 有些许浑浊 |
| ④ | 1 | 1 | 3 | 0.0l | 无明显变化 |
| 编号 | AgNO3浓度/(mol•L-1) | 稀释后Ag+浓度/(mol•L-1) | 混合液中SO42-的最小理论检出浓度/(mol•L-1) |
| ① | 2 | 0.2 | 0.0003 |
| ② | 0.5 | 0.0048 | |
| ③ | 0.1 | 0.0l | 0.12 |
| ④ | 0.001 |
| 编号 | AgNO3溶液 浓度/(mol•L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
| ① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
| ② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍(Be)的氧化物的水化物可能具有两性 | |
| B. | 砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com