
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
A.1 :3 B.2 :3
C.6 :1 D.3 :1
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
只用一种试剂区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
A.Ba(OH)2 B.H2SO4
C.NaOH D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于海水的知识不正确的是( )
A.海水资源的利用包括海水水资源利用和化学资源利用
B.海水既苦又涩,不能直接利用
C.海水中某些金属元素总储量很大,但富集程度却很低
D.海水淡化应同化工生产结合,同能源技术结合
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的方程式不准确的是
A.用浓盐酸检验氨:NH3 +HC1=NH4C1
+HC1=NH4C1
B.碳酸钠溶液显碱性:CO2-3+H2O HCO-3+OH-
HCO-3+OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
用铝箔包裹0.1 mol金属钠,用针扎出一些小孔,放入水中,完全反应后用排水集气法收集产生的气体,则收集到的气体为(标准状况)( )
A.O2和H2的混合气体 B.1.12  L H2
L H2
C.大于1.12 L H2 D.小于1.12 L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下面有关钠、镁、铝的计算及判断。
(1)取w g钠、镁、铝分别与足量盐酸反应,在相同条件下产生氢气的体积之比是________。
(2)取0.1 mol钠、镁、铝分别与足量盐酸反应,在相同条件下产生氢气的体积之比是________。
(3)若产生相同体积(同温同压)的氢气,所需钠、镁、铝三种金属的物质的量之比是________;质量之比是________。
(4)若将0.2 mol钠、镁、铝分别投入10 mL 1 mol·L-1盐酸中,在标准状况下产生氢气体积的大小顺序是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①Fe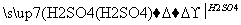 H2
H2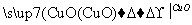 Cu ②CuO
Cu ②CuO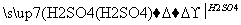 CuSO4
CuSO4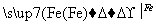 Cu
Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
A.①多 B.②多
C.相等 D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com