
| A. | 澄清石灰水鉴别二氧化碳和二氧化硫 | |
| B. | 用KSCN溶液鉴别FeCl2和Fe2(SO4)3 | |
| C. | 用冷却热饱和溶液的方法鉴别NaCl溶液和KNO3溶液 | |
| D. | 用燃着的木条鉴别N2,H2和O2 |
分析 A.二氧化碳、二氧化硫都可使澄清石灰水变浑浊;
B.三价铁离子和KSCN溶液反应生成络合物硫氰化铁而使溶液呈血红色;
C.硝酸钾的溶解度随温度变化较大;
D.氢气燃烧,氧气助燃.
解答 解:A.二氧化硫和二氧化碳均与石灰水反应生成白色沉淀,现象相同,不能鉴别,故A选;
B.三价铁离子和KSCN溶液反应生成络合物硫氰化铁而使溶液呈血红色,亚铁离子不反应,可鉴别,故B不选;
C.硝酸钾的溶解度随温度变化较大,冷却热饱和溶液可得到大量的晶体,可鉴别,故C不选;
D.氢气燃烧,氧气助燃,氮气可熄灭木条,可鉴别,故D不选.
故选A.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质及性质的差异为解答的关键,注意现象相同不能鉴别物质,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 液氯、干冰均为纯净物 | |
| B. | NO2、CO、CO2均为酸性氧化物 | |
| C. |  与 与 互为同系物 互为同系物 | |
| D. | 淀粉、纤维素和油脂都属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
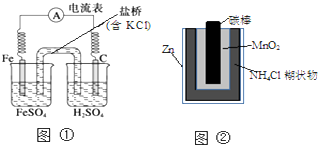
| A. | 图①中正极附近溶液pH降低 | |
| B. | 图②正极反应是2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) | |
| C. | 图①中电子由Fe流向石墨,盐桥中的Cl-移向FeSO4溶液 | |
| D. | Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
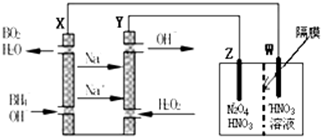
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
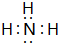 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 受热时,碳酸氢钠比碳酸钠容易分解 | |
| B. | 碳酸氢钠俗名纯碱,碳酸钠俗名苏打 | |
| C. | 碳酸氢钠溶液显酸性,碳酸钠溶液显碱性 | |
| D. | 分别向等物质的量的两种白色粉末中加入等体积等浓度的稀盐酸,生成气体的速率,碳酸氢钠比碳酸钠慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以收集到氯气$\frac{22.4b}{2{N}_{A}}$L | B. | 反应后Cl-数目为bc-d | ||
| C. | NA可表示为$\frac{87d}{2a}$ | D. | 反应后溶液中的H+数目为bc-2d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X和Y与电流表连接,Cu极为正极,发生氧化反应 | |
| B. | X和Y与电流表连接,盐桥中的阴离子移向CuSO4溶液 | |
| C. | X和Y分别与电源“-”、“+”极相连,Cu极质量减轻 | |
| D. | X和Y分别与电源“+”、“-”极相连,Zn极电极反应为4OH--4e-═O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和苯都能发生氧化反应和取代反应 | |
| B. | 乙烯和聚氯乙烯都能发生加成反应 | |
| C. | 乙醇和乙酸分子中都含羟基,都能与NaOH发生反应 | |
| D. | 淀粉、纤维素水解的最终产物互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com