
| A. | 邻-二溴苯只有一种 | |
| B. | 苯分子中所有原子在同一平面上 | |
| C. | 二甲苯没有同分异构体 | |
| D. | 苯既能发生加成反应也能发生取代反应 |
分析 A.若苯分子中含有碳碳双键和单键,则邻-二溴苯应该有两种结构;
B.苯分子中存在单键和双键交替结构时,所有原子也在同一平面上;
C.二甲苯存在3种同分异构体;
D.苯中若含有碳碳双键,也可以发生加成反应和取代反应.
解答 解:A.邻-二溴苯只有一种,证明苯分子中所有碳碳键相同,为一种介于单键与双键之间的独特的键,故A正确;
B.苯分子中所有原子在同一平面上,苯分子中可能存在单键和双键交替的结构,不能证明苯分子中碳和碳之间的化学键是一种介于单键与双键之间的独特的键,故B错误;
C.二甲苯存在邻、间、对三种同分异构体,故C错误;
D.苯分子中含有碳碳双键和单键时,苯既能发生加成反应也能发生取代反应,所以无法证明苯分子中碳碳键为一种独特键,故D错误;
故选A.
点评 本题考查了苯的结构特点,题目难度不大,明确证明苯分子中碳碳键为一种独特键的方法为解答关键,注意掌握苯分子的结构与性质,试题培养了学生的灵活应用能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:解答题
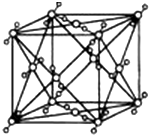 已知A、B、C、D、E都是周期表中的前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外层电子层的P能级(轨道)上的电子处于半充满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一类半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
已知A、B、C、D、E都是周期表中的前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外层电子层的P能级(轨道)上的电子处于半充满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一类半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加KI-淀粉溶液变为蓝色 | |
| B. | 该溶液中Cu2+、NH4+、SO4-、Cl- 可以大量共存 | |
| C. | 与硝酸酸化的AgNO3溶液反应有沉淀生成并放出气体 | |
| D. | 配制该溶液时,将FeBr2粉末溶解在HBr溶液中,并加入少量铁钉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.6g | B. | 6g | C. | 4.8g | D. | 2.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与NaOH反应:OH-+H+→H2O | |
| B. | 硝酸溶液和碳酸氢钠反应:H++2CO32-→CO2↑+H2O | |
| C. | 将溴水加入KI溶液中:Br2+2I-→I2+2Br- | |
| D. | CO2通入澄清石灰水:2OH-+CO2→H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
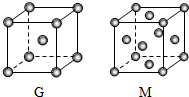 A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大.其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10.
A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大.其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液:Na+、NH4+、SO32-、NO3- | |
| B. | 滴加石蕊试剂呈红色的溶液:Na+、Al3+、SO42-、Cl- | |
| C. | 无色透明溶液:MnO4-、SO42-、K+、NO3- | |
| D. | 强碱性的溶液:Al3+、NH4+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com