
NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋
白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力。
(1)美蓝是亚硝酸盐中毒的有效解毒剂,下列说法正确的是 。(选填编号)
| A.解毒时美蓝表现氧化性 | B.中毒时亚硝酸盐发生氧化反应 |
| C.解毒时高铁血红蛋白被还原 | D.中毒过程中血红蛋白显氧化性 |
(1)C
(2)3 ; r(N3--)>r (O2--)>r(Na+) 。
(3)NaH; NaH属于离子晶体,其余两种氢化物属于分子晶体。
(4)16.8 。
(5)3NO→N2O十NO2; 由于2NO2 N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,使其压强略小于1.01×107 Pa的2/3。
N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,使其压强略小于1.01×107 Pa的2/3。
(6)②
解析试题分析:
(1)A.解毒时美蓝将铁元素由正三价变为正二价表现出还原性。错误。B. NaNO2可将正常的血红蛋白变为高铁血红蛋白,使血红蛋白中的铁元素由二价变为三价,说明NaNO2有强氧化性,它将铁元素由二价变为三价,它本身得到电子被还原,发生还原反应。错误。 C.解毒时高铁血红蛋白铁元素由正三价还原为正二价。高铁血红蛋白得到电子,被还原,发生还原反应。正确。D.中毒过程中血红蛋白显还原性,NaNO2表现氧化性。错误。故选项为C。
(2)钠离子核外电子排布为1s22s22p6,可见在Na+的核外有三种不同能级的电子。Na+、N3-、O2-的核外电子排布都是2、8的电子层结构。对于电子层结构相同的微粒来说,核电荷数越大,微粒的半径就越小。所以它们的半径大小顺序为r(N3--)>r (O2--)>r(Na+) 。
(3)Na、N、O分别与H形成的简单化合物分别是NaH、NH3、H2O。NaH是离子晶体,离子间通过离子键结合,断裂需要消耗较高的中能量,因此熔点较高,而NH3、H2O是分子晶体,分子间以分子间作用力及氢键结合,结合力较小,断裂容易,因此熔沸点较低。故熔点最高的是NaH。
(4)NaNO2发生反应的方程式为:2NaNO2 +4HI =" 2NO↑+" I2 + 2NaI + 2H2O.由方程式可知每有1mol HI被氧化时,转移电子1mol,产生标准状况下的NO气体为22.4L.现在有0.75mol HI被氧化时,则产生的气体在标准状况下产生气体的体积是0.75mol×22.4L/mol=16.8L。
(5)根据题意可得生成N2O的反应方程式为3NO=N2O十NO2。最后的气体压强略小于1.01×107 Pa的2/3原因是因为发生反应2NO2 N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,气体的物质的量减少。气体的物质的量越少,容器的压强就越小。所以其压强略小于1.01×107 Pa的2/3。
N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,气体的物质的量减少。气体的物质的量越少,容器的压强就越小。所以其压强略小于1.01×107 Pa的2/3。
(6)试剂若能使NaNO2转化为N2,由于N的化合价的变化是由+3→O,化合价降低,得到电子,则加入的物质应该有还原性,元素的化合价较低。分析给出的物质只有NH4Cl符合题意。因此选项为②。
考点:考查氧化还原反应的有关知识及计算、原子的结构、离子半径的比较、晶体类型的判断、化学方程式的书写、外界条件对化学平衡移动的影响的知识。


科目:高中化学 来源: 题型:单选题
将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解(产生气体全部逸出),冷却后将溶液稀释至1000ml,测得c(H+)=0.84mol/L;若要使稀释后溶液中的Cu2+沉淀完全,应加入6.0mol/L的NaOH溶液的体积为:
| A.100mL | B.160mL | C.240mL | D.307mL |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol—1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol—1
下列说法不正确的是:
| A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ΔH=-Q,Q>574kJ·mol—1 |
| B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同 |
| C.若用标准状况下4.48L CH4还原NO2至N2,放出的热量为173.4kJ |
| D.若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总物质的量为1.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应:2S2Cl2+2H2O=4HCl+SO2↑+3S↓。对该反应的说法正确的是 ( )。
| A.S2Cl2既作氧化剂又作还原剂 |
| B.氧化产物与还原产物物质的量之比为3∶1 |
| C.每生成1 mol SO2转移4 mol电子 |
| D.H2O作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100 mol·L-1Na2S2O3溶液恰
好把224 mL(标准状况下)Cl2完全转化为Cl-,则S2O42—将转化为( )
| A.S2- | B.S | C.SO32— | D.SO42— |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
| A.原混合物中铜和铁各0.15 mol |
| B.稀硝酸的物质的量浓度为1 mol/L |
| C.第一次剩余的9.6 g金属为铜和铁 |
| D.再加入上述200 mL稀硝酸,还能得到标准状况下2.24 L NO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据以下实验事实,判断选项中四种微粒在酸性条件下,氧化性由强到弱的顺序是( )
(1)向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫红色;
(2)向FeCl2溶液中加入氯水,再加入KSCN溶液,溶液呈红色;
(3)向KMnO4溶液中加入浓盐酸,振荡后紫色褪去。
| A.I2>Cl2>Fe3+>MnO4- |
| B.MnO4->Cl2>Fe3+>I2 |
| C.Cl2>I2>Fe3+,MnO4->Fe3+ |
| D.Fe3+>MnO4->Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,现欲使溶液中的Cl-、Br-、I-的物质的量之比改变成4∶3∶2,那么要通入Cl2的物质的量是原溶液中I-的物质的量的 ( )。
A.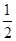 | B. | C.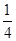 | D. |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
物质的量之比为1∶3的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法正确的是 ( )。
| A.在此反应中硝酸体现强氧化性,全部被还原 |
| B.向反应后的溶液中再加入金属铁,不再发生化学反应 |
| C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4 |
| D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com