
分析 (1)①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,依据氧化还原反应得失电子守恒回答即可;
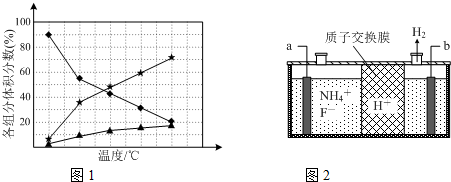
②使湿润的红色石蕊试纸变蓝的气体为氨气,由图1得知:温度越高,肼的百分含量越低,即分解的越快;
(2)①氮化硅中N的非金属性强于Si,Si显+4价,故N显-3价,据此书写化学式;
②由图2可知,氢离子在b极得到电子生成氢气,故b为阴极,那么a为阳极,据此解答即可
解答 解:(1)①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,据此得出还有水生成,氧化还原反应中存在得失电子守恒以及元素守恒,故此反应的离子反应方程式为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O,
故答案为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O;
②使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒得知另外一种产物为氮气,故化学反应方程式为:3N2H4$?_{△}^{催化剂}$N2+4NH3,由图1可知,温度越高,肼的体积分数含量越低,故要抑制肼的分解,应降低反应温度,故答案为:3N2H4$?_{△}^{催化剂}$N2+4NH3;降低反应温度;
(3)①氮化硅中N的非金属性强于Si,Si显+4价,故N显-3价,故氮化硅的化学式为:Si3N4,故答案为:Si3N4;
②由图2可知,氢离子在b极得到电子生成氢气,故b为阴极,那么a为阳极,阳极上铵根失去电子生成NF3,电极反应方程式为:NH4++3F--6e-=NF3+4H+,依据电解原理可知,氟离子也可能失去电子生成氟单质,故氧化性较强的单质为氟气,故答案为:阳;NH4++3F--6e-=NF3+4H+;F2.
点评 本题主要考查的是氧化还原反应方程式书写、电解池反应原理等,综合性较强,难度较大,注意整理归纳.


 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HI的生成速率等于其分解速率 | |
| B. | HI的生成速率小于其分解速率 | |
| C. | HI的生成速率大于其分解速率 | |
| D. | 无法判断HI的生成速率和分解速率的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁丝应始终置于集气瓶瓶口位置 | |
| B. | 迅速将铁丝插入集气瓶接近瓶底位置 | |
| C. | 将铁丝从瓶口位置慢慢伸向瓶底位置 | |
| D. | 铁丝应不断上下移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=1时,乙烯和乙烷的物质的量之比为1:1 | |
| B. | 当a=1时,且反应后CO和CO2的混合气体的物质的量为反应前氧气的$\frac{2}{3}$时,则b=3 | |
| C. | 当a=1时,且反应后CO和CO2的混合气体的物质的量为反应前氧气的$\frac{2}{3}$时,则CO和CO2的物质的量之比为3:1 | |
| D. | a的取值范围为$\frac{5}{6}$<a<$\frac{5}{4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤正确 | B. | 都不正确 | ||
| C. | ④正确,其他不正确 | D. | 仅①不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com