
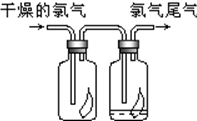
 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、Fe和HCl |
| B、Na和O2 |
| C、Al2O3和HCl |
| D、AlCl3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、氧化铜与稀硫酸反应:CuO+2H+=Cu2++H2O |
| C、氢氧化钡和硫酸溶液反应:OH-+H+=H2O |
| D、铝与稀硫酸反应:Al+2H+=Al3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | MgCl2溶液 | 酚酞溶液 | NaCl溶液 |
| ③ | Na2O | Na2CO3 | NaHCO3 |
| ④ | KOH溶液 | Al | 稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
| B、四氧化三铁溶于稀硝酸:Fe3O4+8H+=4H2O+Fe2++2Fe3+ |
| C、二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
| D、硅酸与烧碱溶液中和:H2SiO3+2OH-═SiO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解Na2SO4 溶液生产H2SO4 和烧碱的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)( )
电解Na2SO4 溶液生产H2SO4 和烧碱的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)( )| A、a极反应式为:2H++2e-=H2↑ |
| B、产物丙为硫酸 |
| C、d为阴离子交换膜 |
| D、Na2SO4 溶液浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | O | ||||||||||||||||

查看答案和解析>>
科目:高中化学 来源: 题型:
| KOH |
| 室温 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com