
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
分析 (1)①工业合成氨是氮气和氢气在催化剂作用下高温高压反应生成氨气;
②依据图标数据分析,平衡常数随温度升高减小,平衡逆向进行说明反应是放热反应
③为了增大平衡时H2的转化率,平衡正向进行分析选项;
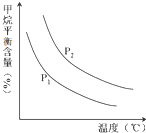
(2)①依据图象变化分析,相同温度下,CH4(g)+H2O (g)═CO(g)+3H2(g),反应是气体体积增大的反应,
②压强一定,温度升高,甲烷平衡含量减小,平衡正向进行,依据平衡移动原理分析判断;
(3)①依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
②化学平衡状态,反应的正逆反应速率相同,各成分含量保持不变分析选项.
解答 解:(1)①合成氨的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,
故答案为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;
②图表中平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应,
故答案为:随温度升高,反应的平衡常数K减小;
③反应是N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,反应是气体体积减小的放热反应,为了增大平衡时H2的转化率,平衡正向进行分析,
a.增大压强,平衡正向进行,氢气转化率增大,故a符合;
b.使用合适的催化剂,改变反应速率,不能改变平衡,氢气转化率不变,故b不符合;
c.升高温度平衡逆向进行,氢气转化率减小,故c不符合;
d.及时分离出产物中的NH3,平衡正向进行,氢气转化率增大,故d符合;
故答案为:ad;
(2)①依据图象变化分析,相同温度下,CH4(g)+H2O (g)═CO(g)+3H2(g),反应是气体体积增大的反应,压强越大,平衡逆向进行,甲烷平衡含量越高,所以P2>P1,故答案为:<;
②压强一定,温度升高,甲烷平衡含量减小,平衡正向进行,正反应为吸热反应,故答案为:吸热;
(3)①向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,
CO(g)+H2O(g)═CO2 (g)+H2(g)
起始量(mol/L) 0.2 0.2 0 0
变化量(mol/L) 0.12 0.12 0.12 0.12
平衡量(mol/L) 0.08 0.08 0.12 0.12
平衡状态下CO转化率=$\frac{0.12mol/L}{0.2mol/L}$×100%=60%,
则该温度下反应的平衡常数K=$\frac{0.12×0.12}{0.08×0.08}$=2.25
故答案为:60%;2.25;
②化学平衡状态,反应的正逆反应速率相同,各成分含量保持不变分析选项,CO(g)+H2O(g)═CO2 (g)+H2(g),反应后气体体积不变;
a.正反应气体体积不变,容器内压强不随时间改变,不能说明反应达到平衡状态,故a不符合;
b.混合气体质量守恒,容器体积不变,反应过程中和平衡状态下,混合气体的密度不随时间改变,不能说明反应达到平衡状态,故b不符合;
c.单位时间内生成a mol CO2的同时消耗a mol H2,是正逆反应速率相同,能说明反应达到平衡状态,故c符合;
d.混合气中各组分物质的量之比决定于反应开始时加入的多少,混合气中n (CO):n (H2O):n (CO2):n (H2)=1:1:1:1,说明物质的量不变,说明反应达到平衡状态,故d符合;
故答案为:cd.
点评 本题考查了化学平衡影响因素,平衡标志分析,平衡常数的计算应用,主要是图象分析判断,平衡移动原理的理解应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 小苏打-Na2CO3 | B. | 钡餐-BaCO3 | ||
| C. | 漂白粉的有效成分-Ca(ClO)2 | D. | 水玻璃-H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35 | B. | 37 | C. | 36 | D. | 35.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的物质是氧化剂 | |
| B. | 失去电子,化合价降低的物质是还原剂 | |
| C. | 还原剂被还原,氧化剂被氧化 | |
| D. | 得到电子,化合价降低的反应物是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1NA个氢气分子所占的体积为22.4 L | |
| B. | 2NA个二氧化碳分子的质量为88 g | |
| C. | 0.1 mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| D. | 17 g NH3中所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制银氨溶液:在一定量氨水溶液中,滴加AgNO3至沉淀恰好溶解 | |
| B. | 配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液 | |
| C. | 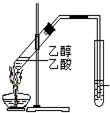 制备乙酸乙酯:用如图所示的实验装置 制备乙酸乙酯:用如图所示的实验装置 | |
| D. | 鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
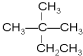 ④癸烷 ⑤CH3COOH
④癸烷 ⑤CH3COOH  ⑦
⑦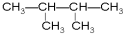 ⑧
⑧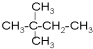 ⑨丙烷
⑨丙烷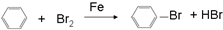 ;
; ;
;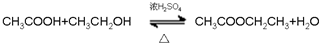 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com