
【题目】下列叙述中正确的是( )
①标准状况下,1 L HCl和1 L H2O的物质的量相同
②标准状况下,1 g H2和14 g N2的体积相同
③28 g CO的体积为22.4 L
④两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑤同温同体积下,气体的物质的量越大,则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A.①②③B.②⑤⑥C.②③⑥D.④⑤⑥
【答案】B
【解析】
①标准状况下,1L HCl的物质的量为![]() ,但标准状况下水为液体,不能利用气体摩尔体积来计算其物质的量,①错误;
,但标准状况下水为液体,不能利用气体摩尔体积来计算其物质的量,①错误;
②标准状况下,1g H2的物质的量为![]() ,14g N2的物质的量为
,14g N2的物质的量为![]() ,两者物质的量相同,则其体积也相同,②正确;
,两者物质的量相同,则其体积也相同,②正确;
③不一定是在标准状况下,不能够准确得出28g CO2的体积,③错误;
④两种物质只有都是气体时,物质的量相同,则他们在标准状况下的体积也相同,即物质的状态不确定,体积可能相同,也可能不同,④错误;
⑤由PV=nRT可以知道,同温同体积时,气体物质的物质的量与压强成正比,则气体物质的物质的量越大,则压强越大,⑤正确;
⑥由PM=ρRT可以知道,同温同压下,气体的密度与气体的相对分子质量成正比,⑥正确;
综上所述,②⑤⑥正确,答案选B。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如下:
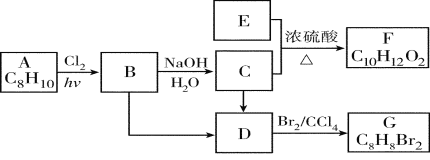
请回答下列问题:
(1)已知:6.0 g化合物E完全燃烧生成8.8 g CO2和3.6 g H2O;E的蒸气与氢气的相对密度为30,则E的分子式为________;
(2)A为一取代芳烃,B中含有一个甲基。由B生成C的化学方程式为:________________;
(3)由B生成D的反应条件是________________;
(4)在G的同分异构体中,苯环上一硝化的产物只有一种的共有________个,其中核磁共振氢谱有两组峰,且峰面积比为1∶1的是_________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,某金属有机多孔材料(MOFA)对CO2具有超高的吸附能力,并能催化CO2与环氧丙烷的反应,其工作原理如图所示。下列说法错误的是
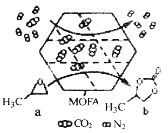
A.物质a分子中碳原子和氧原子均采取sp3杂化
B.b的一氯代物有3种
C.a生成b的反应类型为取代反应,并有极性共价键形成
D.该材料的吸附作用具有选择性,利用此法可减少CO2的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,具有广泛的开发和应用前景。在体积可变的密闭容器中投入0.5molCO和1molH2,不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。下列说法正确的是
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。下列说法正确的是
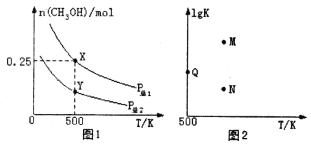
A.P总1<P总2
B.混合气体的密度不再发生变化,说明该反应已达到平衡状态
C.图2中M点能正确表示该反应平衡常数的对数(1gK)与温度的关系
D.若P总1=0.25MPa,则Y点的平衡常数Kp=64(MPa)-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3CH2OH和 ![]() 互为同分异构体,将两种物质分别放在下列检测仪上进行检测,显示出的信号完全相同的是
互为同分异构体,将两种物质分别放在下列检测仪上进行检测,显示出的信号完全相同的是
A.李比希元素分析仪B.红外光谱仪C.核磁共振仪D.质谱仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】薄荷油中含有少量a—非兰烃,其相对分子质量为 136。根据如下转化,回答相关问题。
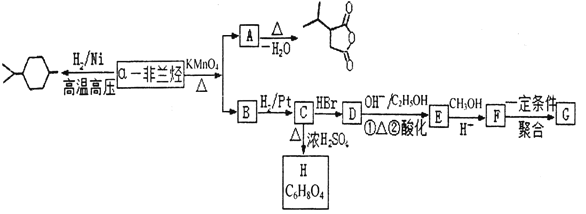
已知:Ⅰ. ![]()
![]()
![]() +RCOOH
+RCOOH
Ⅱ. ![]()
![]()
![]() +CO2
+CO2
Ⅲ.2CH3COOH![]()
![]()
(1)a—非兰烃的结构简式为______。
(2)B 中含有的官能团名称为______,C→D 的反应类型为______。
(3)C→H 的反应方程式为______。
(4)写出符合下列条件 A 的同分异构体______(写三种即可)。
①含有 4 个—CH3②1mol 此同分异构体在碱性条件下水解需 2mol NaOH。
(5)以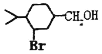 为原料合成
为原料合成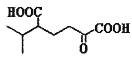 ______。(用流程图表示,其他无机试剂任选)
______。(用流程图表示,其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中常见的荧光棒的发光原理可用下式表示,该反应产生的能量传递给荧光染料,再由染料发出荧光。下列说法正确的是( )
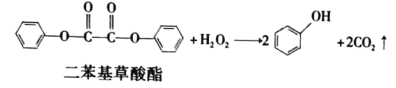
A..上述反应是酯的水解反应
B.二苯基草酸酯的一溴代物有3种
C.二苯基草酸酯在酸性条件下水解生成三种有机物
D.二苯基草酸酯与草酸(![]() )互为同系物
)互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)26H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料1)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀 pH | 7.6 | 2.7 |
完全沉淀 pH | 9.6 | 3.7 |
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________。
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
实验1 | pH=1 | pH=5 | 8.4 |
实验2 | pH=1 | pH=1 | 6.5 |
实验3 | pH=6 | pH=5 | 7.8 |
实验4 | pH=6 | pH=1 | 5.5 |
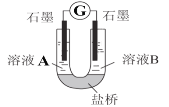
(资料2)原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
(资料3)常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对(资料3)实验事实的解释为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com