

分析 固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等,加入稀硝酸酸溶发生氧化还原反应生成NO,铜和氧化亚铜被氧化得到硝酸铜,氧化铜溶解得到硝铜,二氧化硅和稀硝酸不发生反应,加入氢氧化铜中和酸过滤得到滤渣主要是二氧化硅,滤液主要是硝酸铜溶液,
(1)Cu2O与稀硝酸反应生成硝酸铜、一氧化氮和水;
(2)硝酸加热会发生分解,加快反应速率可以增大浓度、增大接触面积,搅拌等措施;
(3)分析可知过滤后所得废渣的主要成分为二氧化硅;
(4)Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2,依据氧化还原反应电子守恒,原子守恒配平书写化学方程式,溶液中得到溶质固体的方法是蒸发浓缩、冷却结晶、过滤洗涤、低温烘干,防止温度过高硝酸铜分解.
解答 解:固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等,加入稀硝酸酸溶发生氧化还原反应生成NO,铜和氧化亚铜被氧化得到硝酸铜,氧化铜溶解得到硝铜,二氧化硅和稀硝酸不发生反应,加入氢氧化铜中和酸过滤得到滤渣主要是二氧化硅,滤液主要是硝酸铜溶液,
(1)Cu2O与稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu2O+14 H ++2NO3-=6Cu2++2 NO↑+7 H2O,
故答案为:3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O;
(2)硝酸加热会发生分解,酸溶时,反应温度不宜超过70℃,其主要原因是防止温度过高HNO3分解(或者挥发),若保持反应温度为70℃,欲加快反应速率可采取的措施为,加快反应速率可以增大浓度、增大接触面积,搅拌等措施,
故答案为:防止温度过高HNO3分解(或者挥发);搅拌、将固体废渣粉碎、适当提高硝酸的浓度;
(3)分析可知过滤后所得废渣的主要成分为二氧化硅,化学式为:SiO2,
故答案为:SiO2;
(4)Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2,依据氧化还原反应电子守恒,原子守恒配平书写化学方程式,溶液中得到溶质固体的方法是蒸发浓缩、冷却结晶、过滤洗涤、低温烘干,防止温度过高硝酸铜分解;
故答案为:2 Cu(NO3)2 $\frac{\underline{\;\;△\;\;}}{\;}$2 CuO+4NO2↑+O2;冷却结晶;低温烘干.
点评 本题考查了物质分离提纯的实验过程、物质性质的理解应用,主要是氧化还原反应、化学反应速率、溶质析出步骤等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol氮气中所含的氮原子数是0.1NA | |
| B. | 标准状况下,2.24 L乙醇中所含的分子数是0.1NA | |
| C. | 1mol•L-1 氨水溶液中含NH4+的数目是NA | |
| D. | 24g镁和足量的盐酸反应,电子转移的数目是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
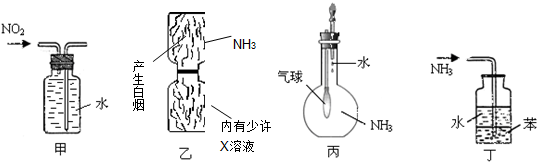
| A. | 图甲:收集NO2气体 | B. | 图乙:验证X溶液为浓硫酸 | ||
| C. | 图丙:验证氨气在水中的溶解性 | D. | 图丁:用于吸收尾气NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
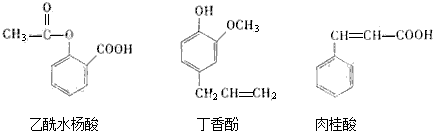
| A. | ②与③ | B. | ③与④ | C. | ①与④ | D. | ②与④ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的 ①CH3COOK ②KHCO3 ③KClO三种溶液的c(K+):①>②>③ | |
| B. | 0.1mol/L NaHC2O4溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(C2O42-)>c(HC2O4- )>c(OH-)>c(H+) | |
| C. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)═c(H+)+c(HS-)+c(H2S) | |
| D. | 向0.2 mol•L-1的氨水中加入少量氯化铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
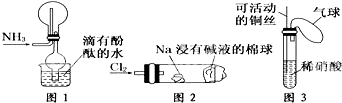
| A. | ②③④ | B. | ①②④ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com