
����Ŀ��ҩ�ﻪ��Ƭ�����ص�Ƭ��ʹ��˵����IJ����������£� 
��1����������˵������ѧ��ѧ֪ʶ�ش�
����Ƭ�к��еĻ��Գɷ�����д����ʽ����
��2��ijѧ��Ϊ��֤����Ƭ��ȷ�������������Գɷ֣����ʵ�����£�����д��
�ٽ�ҩƬ���顢�ܽ⡢���ˣ�������Һ��װ�ڼס������Թ��б��ã�
���ڼ��Թ��м�������һ���Լ��������ã��۲쵽Һ��ֲ㣬���ϲ�Һ����ɫΪ��ɫ���������Լ�Ϊ�����е�������ĸ�����ɴ�˵�����ڷ��ӵ⣮
A������������Һ B���ƾ� C�����Ȼ�̼ D������
�������Թ��еμ���Һ����Һ����ɫ��Ҳ��˵�����ڷ��ӵ⣮
���𰸡�
��1��I2
��2��C������
���������⣺��1����ҩƷ˵����ָ������Ҫ�ɷ��Ƿ��ӵ⣬�ⵥ�ʣ�����ʽΪ��I2 �� ���Դ��ǣ�I2����2���������ƺ͵ⷴӦ���ɴε����ƺ͵⻯�ƣ����ֲ㣬���������л��ܼ����Ҿƾ���ˮ���ֲ㣬��������Ӧ�����ֲ㣬����CCl4�е��ܽ�ȴ�����ˮ�е��ܽ�ȣ��ҵ���CCl4����Ӧ��ˮ��CCl4�����ܣ�����CCl4����ˮ���²㣻��ȡ�����Ȼ�̼�ܶȴ���۲쵽Һ��ֲ㣬�²���Ϻ�ɫ���ϲ㼸����ɫ�����ݵⵥ�������۱���������������ⵥ�ʣ����Դ��ǣ�C�����ۣ�


 ����ѧ����ϵ�д�
����ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��IJ���(C6H12O6)���������������Ʊ�������װ����ͼ1��ʾ�����ȡ�����������̶�װ�þ�����ȥ)��ʵ�������ͼ1��

�ٽ�1:1�ĵ���ˮ��Һ����������(98%)�����ձ��У�ˮԡ������85��90��������30min�� Ȼ�����¶Ƚ���60�����ң�
�ڽ�һ�����ĵ���ˮ��Һ���������ƿ����
�ۿ��Ʒ�ӦҺ�¶���5560�������£��߽�������μ�һ�����������������Ļ��� (65%HNO3��98%H2SO4��������Ϊ 2: 1.5)��Һ��
����Ӧ3h���ң���ȴ����ѹ���˺�ò��ᾧ���Ʒ�����ؽᾧ�ò��ᾧ����������������ˮ��Һ�����пɷ������з�Ӧ��
��C6H12O6+12HNO3��3H2C2O4+9NO2��+3NO��+9H2O
C6H12O6+8HNO3��6CO2+8NO��+10H2O
3H2C2O4+2HNO3��6CO2+2NO��+4H2O
��ش��������⣺
(1) ʵ��ټ���98%����������Ŀ���ǣ�____________��
(2) ʵ����������μӹ����������²�������½�����ԭ����____________��
(3) װ��B��������________��Ϊʹβ��������գ�C���Լ���____________��
(4) �ؽᾧʱ�������ᾧ���Ʒ���ټ����ܽ⡢�ڳ��ȹ��ˡ�����ȴ�ᾧ���ܹ���ϴ�ӡ��ݸ����ʵ�鲽�裬�õ��ϴ����IJ��ᾧ�����ù����пɽ���Ʒ���ܽ�Ƚϴ��������_____(�������������)ʱ��ȥ��
(5)����Ʒ�ں�������Լ90�����º�������أ��õ���ˮ�ϲ�����
������KMnO4����Һ�ζ����÷�Ӧ�����ӷ���ʽΪ��____________����ȡ����Ʒ������ˮ��ȫ�ܽ⣬Ȼ����0.02000mol/L������KMnO4��Һ�ζ����յ�(���ʲ����뷴Ӧ�����ζ�ǰ��ζ����е�Һ�������ͼ2��������KMnO4��Һ�����Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��¡����ݵ��ܱ������У��������A��B��C �����ʵ���Ũ��(c)��ʱ��(t) �Ĺ�ϵ���±���ʾ:
t c | ��ʼ | 2min | 4min | 6min | 8min |
c(A)( mol��L -1) | 2.50 | 2.20 | 2.00 | 2.00 | 2.20 |
c(B)( mol��L -1) | 1.56 | 2.16 | 2.56 | 2.56 | 2.16 |
c(C)( mol��L -1) | 0.39 | 0.54 | 0.64 | 0.64 | 1.54 |
�����:
��1��ǰ2 min�ڣ�v(B)= _______________________��
��2�� ��2 minĩA ��ת����Ϊ_________________��
��3���÷�Ӧ�Ļ�ѧ����ʽΪ_______________________________________��
��4��6 min - 8 min��ֻ�ı��˷�Ӧ��ϵ��ijһ�����ʵ�Ũ�ȣ���ӦΪ_____(��ѡ����ĸ)
a.����A��Ũ�� b.��СB��Ũ�� c.����C��Ũ��
������ʵ�Ũ�ȸı���Ϊ________________mol��L -1
��5���������ͬ�����£�����ʼ������������ʵ����ʵ���Ũ����ԭ����2������_____��ԭ����2����
a. B��ƽ��Ũ�� b. �ﵽƽ���ʱ�� c. ƽ��ʱ������ܶ� d. ƽ�ⳣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼת����ϵ�У�A��B��C��D��E���Ƕ�����Ԫ�صĵ��ʣ��ڳ��³�ѹ��A�ǻ��ý�������������壬��C�ʻ���ɫ��������H��I������������ʱ�������̡�������G����ɫ��ӦΪ��ɫ����Ӧ�ٺ͢ھ�����Һ�н��С��밴Ҫ��ش��������⡣

��1��д���������ʵĻ�ѧʽ��D_______��F________��B___________
��2����Ӧ�ٵ����ӷ���ʽΪ________________________________________
��3����K��Һ�м��������ữ����������Һ����Ӧ������Ϊ____________
��4������������Cͨ��ʢ�е���KI��Һ���Թ��У�Һ���Ϊ��ɫ���÷�Ӧ�����ӷ���ʽΪ__________________________________________________��˵������C��������_________�ڵ��ʵ�(�ǿ��������)��
��5����J��Һ�е���NaOH��Һʱ�����ɵĻҰ�ɫ����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��д�������ɻҰ�ɫ��ɺ��ɫ�Ļ�ѧ����ʽ��___________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л���Ľṹ�������йص�������ȷ����
A.������ϩ����ʹ��ˮ��ɫ���ҷ�Ӧԭ����ͬ
B.��ϩ������ϩ������ͨ���ۺϷ�Ӧ�õ��߷��Ӳ���
C.���������ϩ�Ʊ�������ķ�Ӧ������ȫ��ͬ
D.���״��뱽�Ӿ�����Na��Ӧ��������ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Ԫ�����ʵĵݱ���ɲ���ȷ���ǣ� ��
A. NaOH��KOH��RbOH�ļ�������ǿ B. HCl��H2S��PH3���ȶ�������
C. Na��K��Rb��ԭ�Ӱ뾶�������� D. F2��Cl2��Br2��I2������������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҵ��������Ҫ����Al2O3��Co2O3CoO������Fe3O4�Ƚ��������Co2O3CoO����ǿ�Ӧ����ʵ���ҿƼ���Ա����֮���벢�Ʊ�������ʣ�����������£� 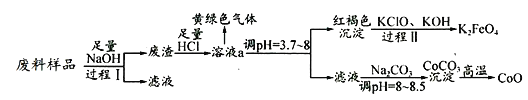
��1�����̢��еIJ���������__��д�����̢�����Ӧ�Ļ�ѧ����ʽ____________��
��2����Һa�к��н��������� _________________��
��3����Һa���ݳ��Ļ���ɫ����������������˵������ȷ����_________��
����������Ư���Ե���������
��Һ�Ⱥ���ˮ��ΪҺ�壬�Ҷ������ȷ���
�۽�����ͨ���Һʱ���������������������ǻ�ԭ��
�ܴ���������ֽ⣬˵��������������
������ˮ�е���������Һ���а�ɫ�������ɣ�˵����ˮ�к�Cl��
��4��д�����̢�����Ӧ�����ӷ���ʽ��_______________________________��
������ص��ܷ�ӦΪ��3Zn+2K2FeO4+8H2O![]() 3Zn��OH��2+2Fe��OH��3+4KOH
3Zn��OH��2+2Fe��OH��3+4KOH
����ʱ������ӦʽΪ___________________________________��
��5��Co�����γ�CoC2O42H2O��MΪ183g/mol����5.49g�þ����ڿ����м��ȣ��ڲ�ͬ�¶��·ֱ�õ�һ�ֹ������ʣ������������
�¶ȷ�Χ���棩 | ����������g�� |
150��210 | 4.41 |
290��320 | 2.41 |
890��920 | 2.25 |
���ⶨ��210�桫290������У�����������ֻ��CO2����˹��̷����Ļ�ѧ��Ӧ����ʽΪ��______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���������ӷ�Ӧ��������������ԭ��Ӧ�ķ��ȷ�Ӧ�ǣ� ��
A. ��Ƭ��ϡ���ᷴӦ B. ���ȵ�̼��CO2��Ӧ
C. Ba(OH)2��8H2O��NH4Cl���巴Ӧ D. �����������е�ȼ�շ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������0.1mol/L Na2CO3��Һ������������ǣ� ��
A.0.5 L����Һ�������ӵ����ʵ���Ũ��Ϊ0.1 mol/L
B.1 L����Һ�к���Na2CO3������Ϊ10.6 g
C.��1 L����Һ��ȡ��100 mL����ȡ����Һ��Na2CO3�����ʵ���Ũ��Ϊ0.01 mol/L
D.ȡ����Һ10 mL����ˮϡ����100 mL��Na2CO3�����ʵ���Ũ��Ϊ0.01 mol/L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com