
【题目】铅蓄电池是典型的可充电电池,电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。回答下列问题:
2PbSO4+2H2O。回答下列问题:
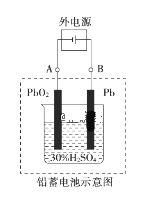
(1)放电时,负极为_______电极,试写出该电极的电极反应式是___________。电解液中H2SO4的浓度将变____________。(填“升高”、 “降低” 或“不变”)
(2)电池放电时,当外电路通过0.1 mol电子时,理论上负极板的质量增加________g,电池中消耗的硫酸物质的量为_______mol。
【答案】Pb Pb-2e-+SO42-=PbSO4 降低 4.8 0.1
【解析】
(1)从总反应Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O看,Pb化合价从0价升高到+2价,其为负极材料;在反应中,Pb最终转化为PbSO4,负极反应式为Pb-2e-+SO42-=PbSO4;正极PbO2也将转化为PbSO4,正极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O,两电极都消耗H2SO4。
2PbSO4+2H2O看,Pb化合价从0价升高到+2价,其为负极材料;在反应中,Pb最终转化为PbSO4,负极反应式为Pb-2e-+SO42-=PbSO4;正极PbO2也将转化为PbSO4,正极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O,两电极都消耗H2SO4。
(2)电池放电时,可建立如下关系式:Pb——2e-——2H2SO4,由外电路通过0.1 mol电子,可求出负极板的质量增加和电池中消耗的硫酸物质的量。
(1)放电时,Pb化合价从0价升高到+2价,其为负极材料,该电极的电极反应式是Pb-2e-+SO42-=PbSO4。两电极都消耗H2SO4,所以电解液中H2SO4的浓度将降低。答案为:Pb;Pb-2e-+SO42-=PbSO4;降低;
(2)电池放电时,可建立如下关系式:Pb——2e-——2H2SO4,当外电路通过0.1 mol电子时,理论上负极板由Pb转化为PbSO4,质量增加![]() =4.8g,电池中消耗的硫酸物质的量为0.1mol。答案为:4.8;0.1。
=4.8g,电池中消耗的硫酸物质的量为0.1mol。答案为:4.8;0.1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.已知某可逆反应:aA(g)+bB(g) ![]() cC(g)+dD(g)。请回答下列问题:
cC(g)+dD(g)。请回答下列问题:

(1)根据实验测定结果,描绘出了该反应达到平衡状态时及改变外界条件后,反应速率与时间的关系图像(如图1所示),有利于提高D产量的变化过程是图像中的______段;引起该变化过程的外界条件是_________________________________________。
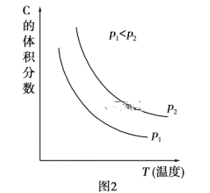
(2)根据实验测定结果描绘出了图2。由此图像可以得出,升高温度,上述平衡将向____(填“正反应”或“逆反应”)方向移动;反应计量数之间的关系:a+b______c+d(填“大于”、“小于”、“等于”或“不确定”)。
Ⅱ.工业合成氨反应如下:N2+3H2![]() 2NH3。请回答下列问题:
2NH3。请回答下列问题:
(1)在一定条件下2L的密闭容器中进行实验,并测得下列数据:
物质 | N2 | H2 | NH3 |
起始(mol) | 2 | 7 | 0 |
10s(mol) | 1.6 | ||
平衡时(mol) | 2 |
则10s内,用氢气表示的化学反应速率是______,该反应的化学平衡常数是________。
(2)根据混合气体各成分的物质性质,你认为工业上将氨气从混合气体中分离出来的措施是________,从而达到反应气体循环利用的目的。实验室检验氨气的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32g碳酸钠、氢氧化钠的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中正确的是( )
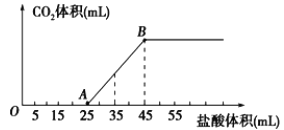
A.OA段发生反应的离子方程式为:H++OH-→H2O
B.B当加入35mL盐酸时,产生CO2的体积为224mL
C.A点溶液中的溶质为NaC1、Na2CO3
D.混合物中NaOH的质量0.60g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.一个CsCl晶胞中含有8个Cl-。
B.离子晶体类的物质均是电解质,故离子晶体均能导电。
C.锗和碳都存在具有原子晶体结构的单质,锗和碳都易形成四个键,能形成原子晶体结构。
D.某物质是由X(黑球)、Y(白球)两种微粒构成的,它们在二维平面中的排列情况为![]() ,则该物质化学式为XY2。
,则该物质化学式为XY2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。
③氨的沸点_______(填“高于”或“低于”)膦(PH3),原因是_______;氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)铜晶体铜碳原子的堆积方式如图所示。
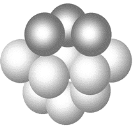
①基态铜在元素周期表中位置__________________。
②每个铜原子周围距离最近的铜原子数目_________。
(4)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。
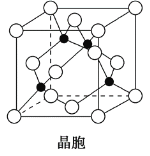
①该晶体的化学式为__________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分

(1)表中非金属性最强的元素为__________(填写元素符号)。
(2)写出元素⑦最高价氧化物对应水化物的化学式___________。
(3)表中元素③和⑤可以组成原子比例为1:1的物质,元素②可以组成一种常见的气体单质,请画出两种分子的电子式____________、____________。
(4)表中元素④⑦氢化物的稳定性由大到小的顺序为:__________ (填写化学式)。
(5)表中有一种元素的单质可作为半导体材料,它在元素周期表中的位置是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
A.58.5 g氯化钠固体中含有![]() 个氯化钠分子
个氯化钠分子
B.1 mol Fe参与反应失去电子数目一定为2![]()
C.1 molNa被完全氧化生成Na202,失去2![]() 个电子
个电子
D.常温下,46 g N02和N204的混合物中含有的氮原子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质:①C60、C70、金刚石、石墨; ②苯甲醇、对甲基苯酚、邻甲基苯酚、间甲基苯酚;③126C、136C、146C;④HOCH2CHO、HOCH2CH2CHO、HOCH2CH2CH2CHO;⑤新戊烷、2,2-二甲基丙烷; ⑥甲醇、乙二醇、丙三醇。属于同位素的是_________、属于同系物的是_________、属于同分异构体的是_________、属于同素异形体的是_________、属于同种物质的的是_________。(填数字序号)
(2)苯的同系物中,有的侧链能被酸性高锰酸钾溶液氧化,生成芳香酸,反应如下:
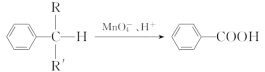 (R、R′表示烷基或氢原子)。
(R、R′表示烷基或氢原子)。
现有苯的同系物甲、乙、丙,分子式都是C10H14。甲不能被酸性高锰酸钾溶液氧化为芳香酸,它的结构简式是________;乙能被酸性高锰酸钾溶液氧化为分子式为C8H6O4的芳香酸,则乙可能的结构有________种。丙的苯环上的一溴代物只有一种。试写出四种丙的结构简式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,物质X可转化为Y,也可转化为Z,转化过程中的能量变化如图所示。下列说法正确的是( )
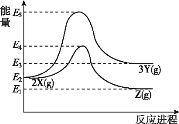
A.由2X→3Y的反应是放热反应
B.X、Y、Z三种物质中最不稳定的是Z
C.反应物总键能大于Z物质的总键能
D.若Y可转化为Z,则相应的反应是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com