
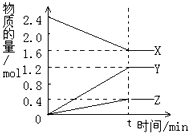
 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.依图所示:分析 ①由图象可以看出,反应中X的物质的量减小,Y、Z的物质的量增多,则X为反应物,Y、Z为生成物.t时刻后,X的物质的量为定值且不为零,为可逆反应,且△n(X):△n(Y):△n(Z)=(2.4mol-1.6mol):1.2mol:0.4mol=0.8mol:1.2mol:0.4mol=2:3:1,得到反应的化学方程式;
②X、Y、Z各物质的量不再随时间的变化而变化,说明达到平衡状态,在3min时间内,用Y表示反应的平均速率v=$\frac{△c}{△t}$.
解答 解:①由图象可以看出,反应中X的物质的量减小,Y、Z的物质的量增多,则X为反应物,Y、Z为生成物.t时刻后,X的物质的量为定值且不为零,为可逆反应,且△n(X):△n(Y):△n(Z)=(2.4mol-1.6mol):1.2mol:0.4mol=0.8mol:1.2mol:0.4mol=2:3:1,物质在反应中物质的量之比等于化学方程式计量数之比,则反应的化学方程式为:2X?3Y+Z;
故答案为:2X?3Y+Z;
②反应起始至t分钟时X、Y、Z各物质的量不再随时间的变化而变化,说明达到平衡状态,v(X)正=v(X)逆,若t=3min,Y的平均反应速率=$\frac{\frac{1.2mol}{2L}}{3min}$=0.2mol/(L•min),
故答案为:=;0.2mol/(L•min).
点评 本题考查化学反应速率变化曲线及其应用,涉及化学方程式、平衡状态、反应速率的计算等问题,题目难度不大,注意相关知识的积累.


科目:高中化学 来源: 题型:解答题
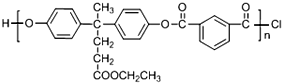
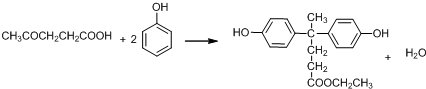
 +SOCl2→
+SOCl2→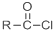 +SO2+HCl
+SO2+HCl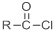 +R′OH→
+R′OH→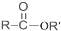 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)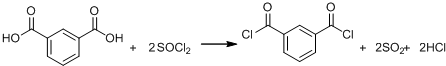 .
. .
. 结构.
结构.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
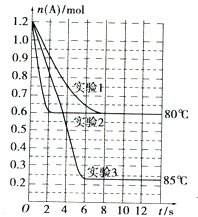 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:| 实验编号 及其目的 | V(容积)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化剂的质量/g | 催化剂的表面积/m2•g-1[来源:Z.xx.k.Com] |
| 实验1 参照对比实验 | 2 | 80 | 1.2 | 0 | a | b |
| 实验4:催化剂的表面积对反应速率的影响 | | | | | | |
| 实验5目的: | 1 | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:
通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:| 实验序号 | 待测样品溶液体积(mL) | 滴定管读数 | 消耗标准盐酸溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.95 | 19.95 |
| 2 | 20.00 | 0.05 | 19.90mL | 19.85mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极 被还原 | B. | 正极 被氧化 | C. | 负极 被还原 | D. | 负极 被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NO3-、OH-、Cl- | B. | H+、Ba2+、Ag+、Cl- | ||
| C. | Fe2+、Fe3+、Na+、NO3- | D. | Ca2+、H+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
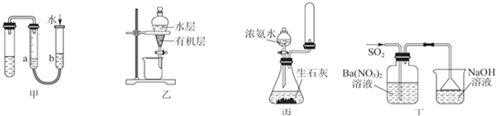
| A. | 用图甲的方法不能检查此装置的气密性 | |
| B. | 图乙可以作为CCl4萃取溴水后的分液装置 | |
| C. | 实验室用图丙所示装置制取少量氨气 | |
| D. | 图丁洗气瓶中的白色沉淀为BaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
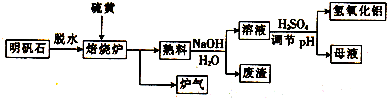
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com