
| 3△H1-△H2-2△H3 |
| 3 |
| 3×(-26.7kJ?mol-1)-(-50.75kJ?mol-1)-2×(-36.5kJ?mol-1) |
| 3 |


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、②④⑤ |
| C、①②③⑤ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-332 | B、-118 |
| C、+350 | D、+130 |
查看答案和解析>>
科目:高中化学 来源: 题型:
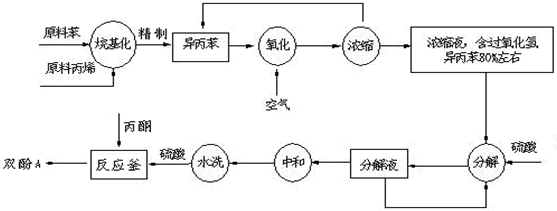
 (2)在氧化操作中,需要严格控制温度,防止温度过高.其原因是:①防止反应过于剧烈②
(2)在氧化操作中,需要严格控制温度,防止温度过高.其原因是:①防止反应过于剧烈②查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当v正(A)═2v逆(C)时,可断定反应已达平衡 |
| B、起始时刻和达平衡后容器中的压强比为 1:1 |
| C、物质A、B的转化率之比为1:2 |
| D、若起始时放入2molA和2amolB,则达平衡时生成2bmolC |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com