
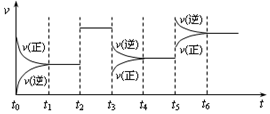
| A. | t2时增加了X的浓度 | B. | t3时增大了压强 | ||
| C. | t5时升高了温度 | D. | t4~t5时间内转化率最大 |
分析 A.t2时正逆反应速率同等程度增大;
B.t3时平衡逆向移动,且速率减小;
C.t5时平衡逆向移动,且速率增大;
D.t2~t3不移动、t3~t4平衡逆向移动、t4~t5平衡逆向移动.
解答 解:A.t2时正逆反应速率同等程度增大,改变条件为使用催化剂,故A错误;
B.t3时平衡逆向移动,且速率减小,改变条件为减小压强,故B错误;
C.t5时平衡逆向移动,且速率增大,且该反应为体积减小、放热反应,则改变条件为升高温度,故C正确;
D.t2~t3不移动、t3~t4平衡逆向移动、t4~t5平衡逆向移动,则t1~t3时间内转化率最大,故D错误;
故选C.
点评 本题考查化学平衡的影响因素,为高频考点,把握温度、压强、浓度对平衡移动的原理为解答的关键,侧重分析与应用能力的考查,注意图象与平衡移动原理的结合,题目难度不大.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 加热能杀死H7N9禽流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 食品包装袋、食物保鲜膜等材料的主要成分是聚乙烯 | |
| D. | 纤维素作为营养物质,在人体内不断分解,最终生成水和二氧化碳排出体外 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
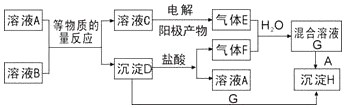
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
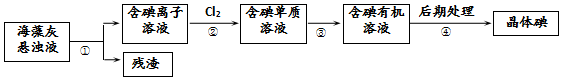
| A. | 步骤④的操作是过滤 | |
| B. | 可用淀粉溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤①、③的操作分别是过滤、萃取 | |
| D. | 步骤③中加入的有机溶剂乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝熔点很高,可用作耐火材料 | |
| B. | 铝热反应原理是炼铁最常用的反应原理 | |
| C. | 过氧化钠可以用作呼吸面具中的供氧剂 | |
| D. | 青铜是我国使用最早的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氮气和NA个一氧化碳分子的质量相等 | |
| B. | NA个O2分子和NA个O3分子的质量相等 | |
| C. | NA个O2和NA个H2的质量比为16:1 | |
| D. | 质量同为16 g的O2、O3中都含有的氧原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②⑤⑥ | C. | ③④⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com