
【题目】从铝土矿![]() 主要成分是
主要成分是![]() ,含
,含![]() 、
、![]() 、MgO等杂质
、MgO等杂质![]() 中提取氧化铝的两种工艺流程如下:
中提取氧化铝的两种工艺流程如下:
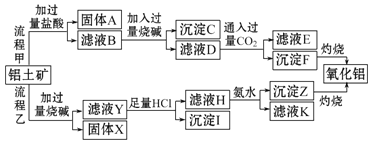
请回答下列问题:
![]() 固体A是______,沉淀F是______,沉淀I是______
固体A是______,沉淀F是______,沉淀I是______![]() 写出有关的化学式
写出有关的化学式![]()
![]() 流程甲中加入过量烧碱得到滤液D的离子方程式为______
流程甲中加入过量烧碱得到滤液D的离子方程式为______
![]() 流程乙加入烧碱有关的化学方程式为______、______
流程乙加入烧碱有关的化学方程式为______、______
![]() 流程乙中滤液H中加入氨水的有关离子方程式______
流程乙中滤液H中加入氨水的有关离子方程式______
![]() 滤液E中溶质的主要成分是___
滤液E中溶质的主要成分是___![]() 填化学式
填化学式![]() ,写出该溶质的一种用途______。
,写出该溶质的一种用途______。
【答案】![]()
![]()
![]()
![]()
![]()
![]()
![]() NaCl、
NaCl、![]() 制纯碱或做发酵粉等
制纯碱或做发酵粉等
【解析】
由工艺流程甲可知,铝土矿与盐酸反应得固体A和滤液B,固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁和盐酸,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;
根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠和氢氧化钠,滤液Y中加入足量盐酸,生成沉淀I为硅酸,滤液H为氯化铝和盐酸,滤液H中加入氨水,沉淀Z为Al(OH)3、滤液K中含有氯化铵,据此分析解答。
(1)由以上分析可知固体A为SiO2,沉淀F为Al(OH)3,沉淀I为H2SiO3,故答案为:SiO2;Al(OH)3;H2SiO3;
(2)滤液B中Al3+与过量烧碱反应的离子方程式为Al3++2OH-=AlO2-+H2O,故答案为:Al3++2OH-=AlO2-+H2O;
(3)流程乙加入烧碱,Al2O3、SiO2能和氢氧化钠反应,有关的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH═Na2SiO3+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH═Na2SiO3+H2O;
(4)流程乙中滤液H中加入氨水的有关离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(5)滤液E中含有NaCl、NaHCO3,碳酸氢钠可用于制纯碱或做发酵粉或做抗酸药等,故答案为:NaCl、NaHCO3;制纯碱或做发酵粉等。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(1)Z在元素中期表中的位置是______________________________。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是__________(填离子符号)。
(3)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式______________________________。
(4)Q和R按原子个数比1:1组成的化合物甲是一种“绿色”氧化剂。
①甲中所含共价键类型是____________________。
②空气阴极法电解制备甲的装置如图所示。在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液。图中a是__________极,阴极的电极反应式是____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol·L-1、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg ![]() 的变化关系如图所示。下列叙述正确的是( )
的变化关系如图所示。下列叙述正确的是( )

A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常温下,由水电离出的c(H+)·c(OH-):a<b
C.相同温度下,电离常数K(HX):a>b
D.lg ![]() =3,若同时微热两种溶液,则
=3,若同时微热两种溶液,则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物 A 的产量可以用来衡量一个国家的石油化工发展水平,B 和 D 是生活中两种常见的有机物。现以 A 为主要原料合成乙酸乙酯,其合成路线如图 1 所示。

(1)B 分子中官能团的名称是____,反应①的反应类型是____反应;
(2)反应②的化学方程式是____,反应④的化学方程式是____;
(3)E 是常见的高分子材料,E 的结构简式是____;
(4)某同学用如图 2 所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。实验时,甲中饱和碳酸钠溶液的作用是(填字母)____。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.加速酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述错误的是
A. 将过量氨气通入CuSO4溶液中可得深蓝色溶液
B. 蛋白质溶于水所得分散系可产生丁达尔效应
C. 硅酸钠溶液与稀盐酸反应可生成硅酸胶体
D. 过量铁粉在氯气中燃烧可生成氯化亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种物质![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 组成一个化学方程式,已知
组成一个化学方程式,已知![]() 等三种物质为反应物,
等三种物质为反应物,![]() 难溶于水.下列判断正确的是
难溶于水.下列判断正确的是![]()
A.![]() 是反应物;
是反应物;![]() 是生成物
是生成物
B.![]() 是反应物;
是反应物;![]() 是生成物
是生成物
C.![]() 是反应物;
是反应物;![]() 是生成物
是生成物
D.![]() 是反应物;
是反应物;![]() 是生成物
是生成物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g) pC(g)的速率和平衡的影响图象如下,下列判断正确的是

A.由图1可知,![]() ,该反应正反应为吸热反应
,该反应正反应为吸热反应
B.由图2可知,该反应![]()
C.图3中,点3的反应速率:v正>v逆
D.图4中,若![]() ,则a曲线一定使用了催化剂
,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代火法炼锌过程中发生了以下三个主要反应。下列说法正确的是( )
① 2ZnS(s) + 3O2(g)=2ZnO(s)+2SO2(g) △H1=a kJ·mol-1
② 2C(s) +O2(g)=2CO(g) △H2=b kJ·mol-1
③ ZnO(s) +CO(g)=Zn(g) +CO2(g) △H3=c kJ·mol-1
A.以上三个反应中,只有①是放热反应
B.反应②的作用是仅为反应③提供还原剂
C.反应 ZnS(s)+C(s)+2O2(g)=Zn(g)+SO2(g)+CO2(g)的△H=![]() (a+b+2c) kJ·mol-1
(a+b+2c) kJ·mol-1
D.碳的燃烧热为![]() b kJ·mol-1
b kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com