
| A. | 15.6% | B. | 25% | C. | 30% | D. | 无法确定 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 第一次与100ml稀硝酸反应剩4.8g金属为Cu和Fe | |
| B. | 反应前稀硝酸的物质的量的浓度为1.5 mol•L-1 | |
| C. | 若向上述最后所得溶液中再加入足量的稀硝酸还可得到标况下0.56LNO | |
| D. | 原混合物中Cu和Fe的物质的量分别为0.06mol和0.09mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
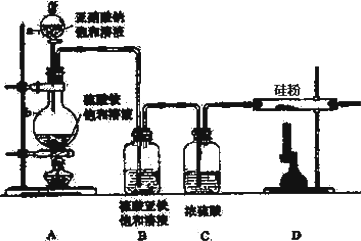
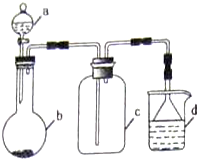
| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Fe | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.2×10-10 mol/L | B. | 2.2×10-12 mol/L | C. | 2.2×10-14 mol/L | D. | 1.1×10-21 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ K+ S${O}_{4}^{2-}$ N${O}_{3}^{-}$ | B. | Mg2+ N${H}_{4}^{+}$ S${O}_{4}^{2-}$ Cl- | ||
| C. | Na+ K+ S${O}_{4}^{2-}$ N${O}_{3}^{-}$ | D. | Ba2+ Na+ Mn${O}_{4}^{-}$ S${O}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
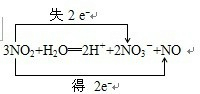 .
.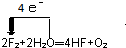 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
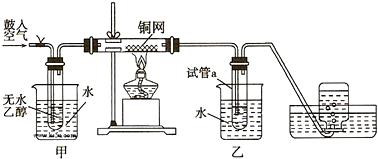
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com