
| A. | Li、Na、K | B. | Na、Mg、Al | C. | Li、Be、Mg | D. | Li、Na、Mg |
分析 金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔点越高,据此判断.
解答 解:A.Li Na K的价电子数相同,原子半径依次增大,则金属键依次减弱,所以Li Na K的熔点依次降低,故A错误;
B.Na Mg Al的价电子数依次增多,原子半径依次减小,则金属键依次增强,所以Na Mg Al的熔点依次升高,故B正确;
C.Be Mg的价电子数相同,原子半径依次增大,则金属键依次减弱,所以Be的熔点大于Mg,故C错误;
D.Li Na 的价电子数相同,原子半径依次增大,则金属键依次减弱,所以Li的熔点大于Na,故D错误;
故选B.
点评 本题考查金属晶体熔点的比较,明确金属晶体熔点的比较方法是解答本题的关键,题目难度不大.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C与${\;}_{6}^{14}$C互为同位素 | B. | 乙烯分子的结构简式:CH2=CH2 | ||
| C. | 氟离子结构示意图: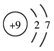 | D. | -OH的电子式: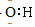 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在平衡常数表达式中,反应物浓度用起始浓度,生成物用平衡浓度 | |
| B. | 在任何条件下,化学平衡常数是一个恒定值 | |
| C. | 平衡常数的大小只与温度有关,而与浓度、催化剂等无关 | |
| D. | 改变压强,化学平衡常数不一定发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
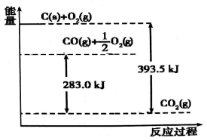
| A. | 1mol C完全燃烧生成CO2时放出的热量为393.5 kJ/mol | |
| B. | 2C(s)+O2(g)═2CO(g)△H=-221.0 kJ/mol | |
| C. | 2CO2 (g)═2CO(g)+O2(g)△H=+283.0 kJ/mol | |
| D. | C(s)+O2(g)═CO2 (g)△H=+393.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
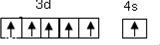 .
.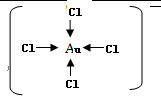 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁跟稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | Ca(HCO3)2溶液和盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | CaCO3跟稀硫酸反应:CaCO3+H++SO42-═CaSO4+H2O+CO2↑ | |
| D. | 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷没有同分异构体 | |
| B. | CH(CH3)2CH2CH2CH3的一氯代物有4种 | |
| C. | 二氯苯有3种,则四氯苯有6种 | |
| D. | CH3OH与CH2OH-CH2OH都属于醇,互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
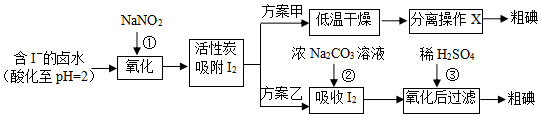
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com