
| A. | 无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、AlO2- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 含有大量AlO2-的溶液中:Mg2+、Al3+、SO42-、Cl- | |
| D. | 紫色石蕊试液呈红色的溶液中:Ca2+、K+、CO32-、NO3- |
分析 A.无色酚酞试液呈红色的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
B.铜离子为有色离子;
C.偏铝酸根离子与铝离子、镁离子发生双水解反应;
D.紫色石蕊试液呈红色的溶液中存在大量氢离子,碳酸根离子与钙离子、氢离子反应.
解答 解:A.无色酚酞试液呈红色的溶液为碱性溶液,溶液中存在大量氢氧根离子,Na+、K+、SO42-、AlO2-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.Cu2+为有色离子,不满足溶液无色的条件,故B错误;
C.AlO2-与Mg2+、Al3+发生双水解反应,在溶液中不能大量共存,故C错误;
D.紫色石蕊试液呈红色的溶液为酸性溶液,溶液中存在大量氢离子,Ca2+、CO32-之间反应生成碳酸钙沉淀,CO32-与氢离子反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查了离子共存的判断,题目难度中等,明确离子反应发生条件为解答关键,注意熟练掌握常见离子不能共存的情况,如生成沉淀、气体、水,发生双水解反应等,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
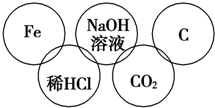 小美在五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应.请完成下列问题:
小美在五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应.请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 用新制Cu(OH)2悬浊液检验乙醛中醛基:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O | |
| C. | 实验室用液溴和苯在催化剂作用下制溴苯: +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ +HBr +HBr | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)═1×10-13mol/L的溶液中,CO32-、K+、SO42-、Cl-在溶液中可能大量存在 | |
| B. | 25℃、101kPa下,1 g氢气燃烧生成液态水放出142.9 kJ热量,其热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ•mol-1 | |
| C. | 浓度均为0.lmol•L-1Na2CO3和NaHCO3混合液中:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,5molFeS2发生反应,有14mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用溴水检验汽油中是否含有不饱和脂肪烃 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用蒸馏的方法可以分离醋酸与乙醇的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 4 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 得电子越多的氧化剂,其氧化性就越强 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 有单质参加的反应不一定属于氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com