
下列指定反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O = 2H++Cl-+ClO-
B.NaHCO3的电离方程式:NaHCO3 = Na+ + H+ +CO32-
C.Fe 与盐酸反应:2Fe+6H+=2Fe3++3H2↑
D.Ba(OH)2和 CuSO4溶液反应:Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓
科目:高中化学 来源:2016-2017学年江西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
根据下表中有关短周期元素性质的数据,下列说法不正确的是( )
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
原子半径(10﹣10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
主要化合价 | 最高价 | / | +2 | +1 | +5 | +7 | +1 | +5 | +3 |
最低价 | ﹣2 | / | / | ﹣3 | ﹣1 | / | ﹣3 | / | |
A. 元素原子序数④大于⑦ B. ②③号元素不可能处于同一周期
C. ⑤号元素最高价氧化物对应水 化物的酸性最强 D. ⑧号元素是金属元素
化物的酸性最强 D. ⑧号元素是金属元素
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(五)化学 试卷(解析版) 题型:简答题
钒和镍及其化合物是重要的催化剂和合金材料。
(1)基态V原子的价层电子排布式为________,其中排布时能量最高的电子所占据能级的原子轨道有________个仲展方向。
(2)VO2+与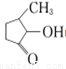 可形成配合物。
可形成配合物。 中,三种非金属原子的第一电离能由大到小的顺序为________(用元素符号表示);C原子的杂化轨道类型为_________。
中,三种非金属原子的第一电离能由大到小的顺序为________(用元素符号表示);C原子的杂化轨道类型为_________。
(3)镍形成的[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子中N原子的价层电子对数目为______。与CN-互为等电子体的一种分子的化学式为__________。
(4)La-Ni合金是重要的储氢材料,储氢后的晶胞如图所示。
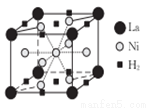
①合金中,1个La原子周围距离最近且相等的La原子数目为_______。
②含有1mol Ni原子的合金中储存H2的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(五)化学 试卷(解析版) 题型:选择题
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A. 简单离子半径:W<X<Z B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y D. 最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源:天津市红桥区2017届高三一模化学试卷 题型:填空题
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第________周期,第______族;
(2)X可形成双原子分子,其分子的电子式是_________;Y和氢元素形成的10电子微粒中常见+1价阳离子为_______(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式__________。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式_________________________。
(4)将0.20molYZ2和0.10molO2充入一个固定容积为5L的密闭容器中,在一定温度并有催化剂存在下,进行反应,经半分钟达到平衡,测得溶液中含YZ30.18mol,则v(O2)=________mol/(L·min);若温度不变,继续通入0.20molYZ2和0.10molO2,则平衡_______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(YZ3)<_______mol。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省、惠安一中、泉州实验中学高一上学期期末联考化学试卷(解析版) 题型:填空题
现有八种物质:①铝 ②氯气③A12O3 ④H2SO4 ⑤稀硝酸⑥稀氨水⑦Ba(OH)2固体⑧A12(SO4)3请按要求回答下列问题:
(1)属于电解质的是______________(填序号)。
(2)m mol ②的质量为a g,则b g该气体在标准状况下的体积为_______L (用m、a、b表示) 。
(3)17.1g ⑧溶于水配成500mL溶液,则溶液中SO42ˉ的物质的量浓度为__________。
(4)写出最适宜制取Al(OH)3的离子方程式:__________________。
(5)两物质溶液间发生反应的离子方程式为H++ OH― = H2O,请写出该反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省、惠安一中、泉州实验中学高一上学期期末联考化学试卷(解析版) 题型:选择题
为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A. NaHCO3溶液(Na2CO3溶液): 通入过量的CO2
B. 铁粉(铝粉): 加入适量的NaOH溶液过滤
C. Na2CO3溶液(Na2SO4溶液): 加入适量的Ba(OH)2溶液过滤
D. Cl2(HCl): 将混合气体通入饱和食盐水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一下学期第一次(3月)阶段检测化学试卷(解析版) 题型:填空题
请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是 (填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
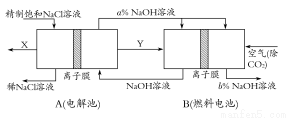
①图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应,正极: ;负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二开学质检(3月)化学试卷(解析版) 题型:简答题
(1)Na2CO3溶液中滴加酚酞呈红色,原因是____________________(用离子方程式表示)。加热后颜色变________(填“深”或“浅”),0.1mol/L Na2CO3溶液和,0.1mol/L NaHCO3溶液比较,水的电离程度前者________后者(填“>”“等于”或“<”)。

(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2电池,其电池总反应为2Al+3HO2-=2AlO2-+OH-+H2O。现以Al—H2O2电池电解尿素的碱性溶液制备氢气,尿素的结构简式为:(右池中隔膜仅阻止气体通过,b、c、d均为惰性电极)。试回答下列问题:

①右池是____________池;
②电极b是_______极,其电极反应式为__________________。
③通电2min后,Al电极质量减轻2.7g,则产生N2的体积为__________(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com