
【题目】下列有关离子方程式或离子共存的叙述正确的是
A. 将磁性氧化铁溶于氢碘酸: Fe3O4+ 8H+= 2Fe3++ Fe2+ + 4H2O
B. 用肥皂(主要成份C17H35COONa)检验含有较多钙离子的硬水:2C17H35COO-+Ca2+=(C17H35COO)2Ca↓
C. 常温下,在![]() =0.1的溶液中:Na+、K+、AlO2-、HCO3-能大量共存
=0.1的溶液中:Na+、K+、AlO2-、HCO3-能大量共存
D. 在NaClO溶液中:SO32-、OH-、Cl-、K+
【答案】B
【解析】A,将磁性氧化铁溶于氢碘酸生成FeI2、I2和H2O,反应的化学方程式为Fe3O4+8HI=3FeI2+I2+4H2O,离子方程式为Fe3O4+8H++2I-=3Fe2++I2+4H2O,A项错误;B,C17H35COO-与硬水中的Ca2+形成难溶于水的(C17H35COO)2Ca,离子方程式正确,B项正确;C,AlO2-与HCO3-能反应生成Al(OH)3和CO32-,不能大量共存,常温下,![]() =0.1的溶液呈碱性,HCO3-在碱性溶液中不能大量存在,C项错误;D,NaClO具有强氧化性,SO32-具有还原性,在NaClO溶液中SO32-不能大量存在,发生的反应为ClO-+SO32-=Cl-+SO42-,D项错误;答案选B。
=0.1的溶液呈碱性,HCO3-在碱性溶液中不能大量存在,C项错误;D,NaClO具有强氧化性,SO32-具有还原性,在NaClO溶液中SO32-不能大量存在,发生的反应为ClO-+SO32-=Cl-+SO42-,D项错误;答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 用石墨电极电解MgCl2溶液:Mg2++ 2C1- + 2H2O![]() Mg(OH)2↓+ Cl2↑+ H2↑
Mg(OH)2↓+ Cl2↑+ H2↑
B. 向碳酸氢铵溶液中加入足量石灰水: Ca2++ HCO3- + OH–![]() CaCO3↓+H2O
CaCO3↓+H2O
C. 向氢氧化钡溶液中加入硫酸氢钠至溶液为中性: Ba2++OH– + H+ + SO42-![]() BaSO4↓+H2O
BaSO4↓+H2O
D. 向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I- == 3I2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出泡沫灭火器(硫酸铝和碳酸氢钠溶液) 灭火时发生反应的离子方程式:_______________。
(2)常温下若溶液由pH=3的HA溶液V1mL 与pH=11的NaOH溶液V2mL混合而得正确的有_______________。
A.若混合后溶液呈中性:c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(3)常温下,浓度均为0.1mol/L的下列五种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mo/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是_________。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是_________。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(4)某温度时,测得0.01mol·L-1 的NaOH溶液的pH为10。若将此温度下pH=10的NaOH 溶液aL与pH=1的稀硫酸bL混合,(设混合后溶液体积的微小变化忽略不计),若所得混合液pH=2,则a:b=_______。
(5)25℃,用0.1000 mol/LNaOH 溶液滴定20.00mL0.1000mol/L 某一元酸HA溶液所得滴定曲线如图。

①为减小实验误差,滴定时应选用适当的指示剂,判断该滴定终点的现象为(必须描述颜色的变化)______________________。
②A、B、C三点所示溶液导电能力最强的是___________点对应的溶液;
③比较A、C两点中水的电离程度:A_______C (填“>”、“ =”或“<”)。
(6)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________________。
(7)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入__________调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________mol/L。[Fe(OH)3的Ksp=2.6×10-39]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世上万物、神奇可测,其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_____(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为____,Q2+的未成对电子数是_____。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①制元素在周期表中的位置是______,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有______(填字母)。
A离子键 B金属键 C.配位键 D.非极性键 E极性键
③NH3中N原子的杂化轨道类型是______,写出一种与SO42-互为等电子体的分子的化学式:_ ______。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物.则[Cu(NH3)4]2+的空间构型为_________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示。则该化合物的化学式为_____,如果该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____(用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.22.4L CO2含有NA个分子
B.常温常压下,0.1mol Na2CO3含有的Na+数目为0.1NA
C.常温常压下,18gH2O含有的氢原子数为2NA
D.物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的部分框架,请回答:

(1)根据元素周期表回答下面问题:
(a)写出元素⑥在周期表中的位置___________;元素⑦和元素⑧的最高价氧化物的水化物中酸性较强是___________(用化学式表示)。
(b)元素②与元素⑨形成的化合物属于___________(填“共价”或“离子”,下同)化合物.元素⑤与元素⑨形成的化合物属于___________化合物。
(c)请写出元素②的原子结构示意图为___________;元素②的最高价氧化物结构式为:___________;元素①﹣④中的某单质在常温下化学性质稳定,通常可以做保护气,请用电子式表示其分子___________。
(2)元素周期表中位于斜对角线的两种元素及其性质十分相似,称之为对角线法则.根据元素周期表对角线法则,金属铍(Be)与铝单质及其化合物性质十分相似.
(a)写出证明Al2O3是两性物质的化学反应的离子方程式:___________,___________。
(b)下列关于铍的判断正确的是__________
A.氧化铍的化学式为Be2O3 B.Be(OH)2可溶于水
C.BeCl2是离子化合物 D.Be(OH)2具有两性
(c)Be(OH)2和Mg(OH)2可用试剂___________鉴别。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学―有机化学基础]
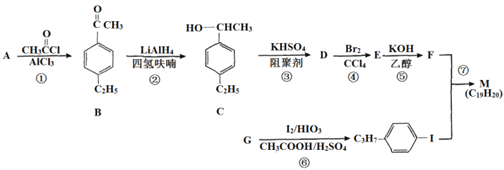
化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
回答下列问题:
⑴G的结构简式为_____________________
⑵C中含有的官能团名称是________
⑶反应②的反应类型是_________,反应⑥的反应类型是______
⑷反应⑤的化学方程式为________________________
⑸能同时满足下列条件的B的同分异构体有____种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积之比为6:2:2:l:l的是_________(写结构简式)。
①苯环上有两个取代基 ②能发生银镜反应
⑹参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线_________。
的合成路线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为: ![]() +H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅
B. NO2和N2O4平衡混合气缩小体积加压后颜色先变深后变浅一点
C. 氢气和碘蒸气反应达平衡后加压颜色加深
D. 硫酸工业上SO2氧化成SO3,通入过量的空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com