
| A. | 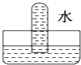 | B. | 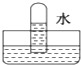 | C. | 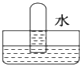 | D. | 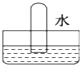 |
分析 NO不溶于水,SO2与水发生SO2+H2O=H2SO3,NO2与水发生3NO2+H2O=2HNO3+NO,Cl2与水发生Cl2+H2O?HCl+HClO,以此来解答.
解答 解:NO不溶于水,如图D所示;
SO2与水发生SO2+H2O=H2SO3,水充满试管,如图A所示;
NO2与水发生3NO2+H2O=2HNO3+NO,所以液体会充满试管体积的三分之二,三分之一的部分被NO占有,图B符合;
Cl2与水发生Cl2+H2O?HCl+HClO,氯气微溶于水,选项中现象不符合,
故选B.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意氯气微溶于水,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,故可在常温下用铝制贮藏贮运浓硫酸 | |
| B. | 实验室可利用锌与稀硫酸反应制氢气 | |
| C. | 蔗糖中滴入浓硫酸可观察到蔗糖由白变黑,后体积膨胀并产生大量有刺激性气味的气体,该过程中浓硫酸体现了脱水性和强氧化性 | |
| D. | 在以稀硫酸为电解质溶液的铜、锌原电池中,溶液中的SO42-向原电池的正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸晶体(H2C2O4•2H2O)的工艺流程如图:
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸晶体(H2C2O4•2H2O)的工艺流程如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
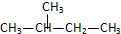 和
和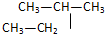
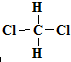 和
和
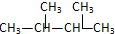 和
和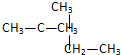
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
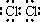 .
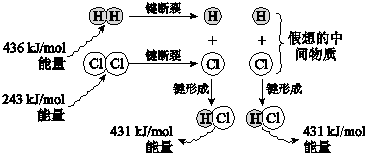
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
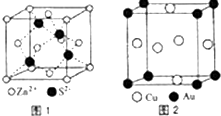 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、CuCu5Zn8等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、CuCu5Zn8等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
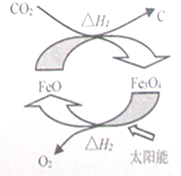 太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是(NA为阿伏伽德罗常数的值)( )
太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是(NA为阿伏伽德罗常数的值)( )| A. | 分解1molFe3O4转移电子数为2NA | |
| B. | 根据盖斯定律可知,△H1+△H2=0 | |
| C. | FeO在CO2转化为C的过程中的作用是催化剂 | |
| D. | CO2中σ键与π键个数之比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com