
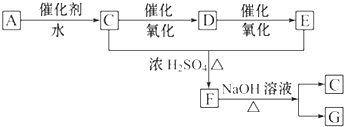
分析 气体A的产量是衡量一个国家石油化工发展水平的标志,所以A是乙烯,结构简式为CH2=CH2,CH2=CH2和水发生加成反应生成乙醇,则C结构简式为CH3CH2OH,CH3CH2OH被氧化生成乙醛,D结构简式为CH3CHO,D被氧化生成乙酸,E为CH3COOH,CH3CH2OH和CH3COOH发生酯化反应生成乙酸乙酯,则F结构简式为CH3COOCH2CH3,乙酸乙酯在碱性条件下水解生成G为CH3COONa,以此解答该题.
解答 解:气体A的产量是衡量一个国家石油化工发展水平的标志,所以A是乙烯,结构简式为CH2=CH2,CH2=CH2和水发生加成反应生成乙醇,则C结构简式为CH3CH2OH,CH3CH2OH被氧化生成乙醛,D结构简式为CH3CHO,D被氧化生成乙酸,E为CH3COOH,CH3CH2OH和CH3COOH发生酯化反应生成乙酸乙酯,则F结构简式为CH3COOCH2CH3,乙酸乙酯在碱性条件下水解生成G为CH3COONa,
(1)由以上分析可知C为CH3CH2OH,官能团为羟基,故答案为:羟基;
(2)乙醇在铜作催化剂、加热条件下发生氧化反应生成乙醛,反应方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
乙烯在催化作用下可与水发生加成反应生成乙醇,方程式为CH2=CH2+H2O $\stackrel{催化剂}{→}$ CH3CH2OH,
乙酸乙酯在碱性条件下水解生成G为CH3COONa,方程式为CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH,
故答案为:①2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;②CH2=CH2+H2O $\stackrel{催化剂}{→}$ CH3CH2OH;③CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH.
点评 本题考查有机物推断,为高考常见题型,侧重于学生的分析能力的考查,涉及烯烃、醇、醛、羧酸、酯、氯代烃之间的转化,明确有机物中官能团及其性质即可解答,熟练掌握常见有机物反应类型,题目难度不大.


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
| A. | 物质的量:④<①<②<③ | B. | 体积:④<①<③<② | ||
| C. | 质量:④<①<③<② | D. | 氢原子个数:②<④<③<① |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
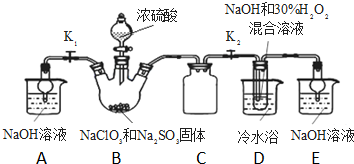 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 浓硫酸 | Na2SO3 | 品红溶液 | SO2具有漂白性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  2-甲基-1-丙醇 2-甲基-1-丙醇 | |
| B. | 石油的主要成分是碳氢化合物 | |
| C. | 碳氢化合物中的化学键都是极性键 | |
| D. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com