
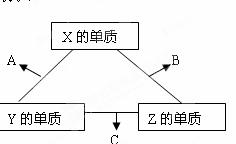
 X、Y、Z三种短周期元素,它们的原子序数之和为16 。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16 。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。请回答下列问题:
(1)X元素在周期表中的位置________ _。
(2)X的单质与Z的单质可制成新型的化学电(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________(填物质名称);负极电极反应式为___________________ _。
(3)C在一定条件下反应生成A的化学方程式是_______________________________。
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,属于放热反应。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是____________________(填写下列各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为11
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大
科目:高中化学 来源: 题型:
浓度都是1 mol·L-1的四种正盐溶液:AX、BX、AY、BY;AX的溶液pH=7且溶液中 c(x-)=1 mol·L-1,BX的溶液pH=4,BY的溶液pH=6。则AY的溶液pH为 ( )
A.大于7 B.等于7 C.小于7 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,下列判断正确的是( )
A.元素金属性:B>A;元素非金属性:D>C B.原子半径:A>B>C>D
C.离子半径:D(n+1)->Cn->B(n+1)+>An+ D.原子序数:b>a>c>d
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是 ( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属腐蚀与防护的说法正确的是
A.在铁门上焊接铜块能防腐蚀
B.镀锡铁制品的镀层破损后,镀层仍能对铁制品起保护作用
C.钢柱在水下部分比在空气与水交界处更容易腐蚀
D.在海轮外壳连接锌块,保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2H2S(g)  2H2(g)+S2(g) ΔH >0,其他条件不变,下列说法正确的是
2H2(g)+S2(g) ΔH >0,其他条件不变,下列说法正确的是
A.加入催化剂,反应路径将发生改变,ΔH也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,体系温度降低
D.恒容体系,充入H2重新达到平衡后,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
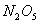 是一种新型硝化剂,在一定温度下可发生以下反应:
是一种新型硝化剂,在一定温度下可发生以下反应:
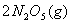

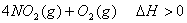
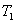 温度时,向密闭容器中通入
温度时,向密闭容器中通入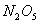 ,部分实验数据见下表:
,部分实验数据见下表:
|
| 0 | 500 | 1000 | 1500 |
|
| 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是( )
A. 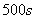 内
内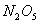 分解速率为
分解速率为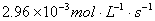
B. 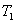 温度下的平衡常数
温度下的平衡常数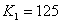 ,平衡时
,平衡时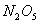 的转化率为50%
的转化率为50%
C. 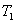 温度下的平衡常数为
温度下的平衡常数为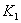 ,
,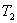 温度下的平衡常数为
温度下的平衡常数为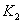 ,若
,若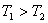 ,则
,则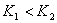
D. 达平衡后其他条件不变,将容器的体积压缩到原来的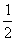 ,则再次平衡时
,则再次平衡时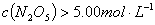
查看答案和解析>>
科目:高中化学 来源: 题型:
几种中学化学常见的单质及其化合物相互转化的关系如下图所示:
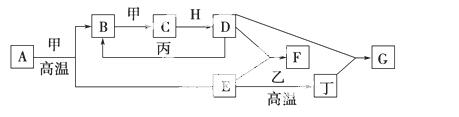
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8 。
③B常温下为无色有刺激性气味的气体,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为________。
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式:________________________________________________________________。
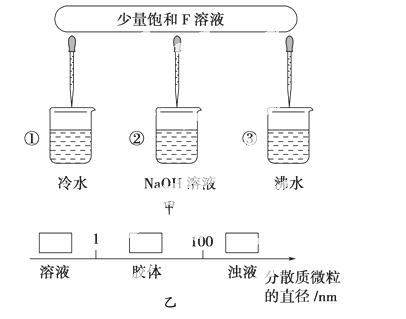
(3)如图甲所示,将少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。
试将①②③填入图乙方框中。
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引入新的离子。试写出M在酸性环境下将G氧化为F的离子方程式:_______________
_ ________________________________________________________。
________________________________________________________。
(5)已知丙单质与D的浓溶液 按物质的量之比为1∶2恰好反应生成B气体的化学转化式为:丙+D(浓) B↑+丙的氧化产物+水,则丙在其氧化产物中的化合价为:________。
按物质的量之比为1∶2恰好反应生成B气体的化学转化式为:丙+D(浓) B↑+丙的氧化产物+水,则丙在其氧化产物中的化合价为:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com