
①NaHSO4 ②NaH2PO4 ③NaHCO3 ④NaHS ⑤Na3PO4 ⑥CuCl2 ⑦Fe2(SO4)3
A.①②③④ B.④⑤⑥⑦ C.①②⑥⑦ D.③④⑥⑦
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
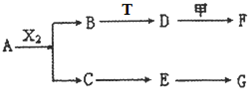 下列物质有如下转化关系(有的生成物未列出,反应条件均省略),其中:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色,D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
下列物质有如下转化关系(有的生成物未列出,反应条件均省略),其中:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色,D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||


| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013届新课标高三配套月考(二)化学试卷(A卷)(带解析) 题型:填空题
[2012·北京大兴一模](11分)下表为元素周期表的一部分,请参照①-⑦相关元素在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为 ;②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(2)由②④⑤三种元素组成的常见物质的水溶液显碱性,用离子方程式表示溶液显碱性的原因:________ ___。
(3)甲、乙是由②③④三种元素中一种或两种元素形成的双原子分子或负二价阴离子,它们的电子总数相等,甲与钙元素组成的化合物既含离子键又含非极性共价键,则该化合物的电子式为:__________,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:__________ __。
(4)已知在25℃、101 kPa下,⑦的气态氢化物在氧气中完全燃烧后恢复至原状态,每转移l mol电子时放热190.0kJ,该反应的热化学方程式可表示为____ 。
(5)以⑥的单质材料为阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成有吸附性的难溶物R,写出阳极生成R的电极反应式:_______ ____。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新课标高三配套月考(二)化学试卷(A卷)(解析版) 题型:填空题
[2012·北京大兴一模](11分)下表为元素周期表的一部分,请参照①-⑦相关元素在表中的位置,用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序为 ;②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(2)由②④⑤三种元素组成的常见物质的水溶液显碱性,用离子方程式表示溶液显碱性的原因:________ ___。
(3)甲、乙是由②③④三种元素中一种或两种元素形成的双原子分子或负二价阴离子,它们的电子总数相等,甲与钙元素组成的化合物既含离子键又含非极性共价键,则该化合物的电子式为:__________,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:__________ __。
(4)已知在25℃、101 kPa下,⑦的气态氢化物在氧气中完全燃烧后恢复至原状态,每转移l mol电子时放热190.0kJ,该反应的热化学方程式可表示为____ 。
(5)以⑥的单质材料为阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成有吸附性的难溶物R,写出阳极生成R的电极反应式:_______ ____。
查看答案和解析>>
科目:高中化学 来源:2012年北京市大兴区高考化学一模试卷(解析版) 题型:解答题
| 族 周期 | ⅠA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com